AUTOR: Fernando Lamata Cotanda.
Presidente de la Comisión Editorial de la rAJM
Revista Nº 23 Septiembre 2023
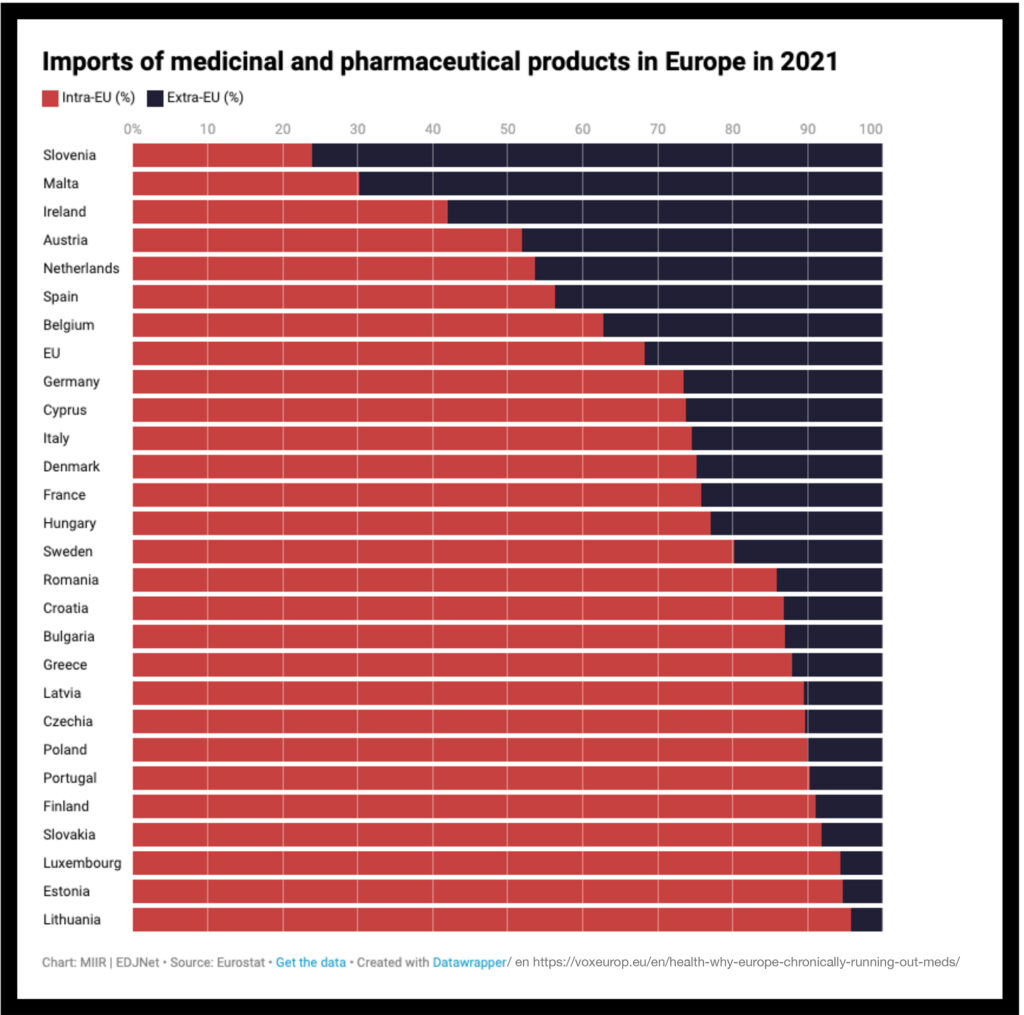
Un reciente artículo de Ana Valladolid en el número 22 de la rAJM llama la atención sobre el problema de los desabastecimientos de medicamentos, cada vez más frecuente, tanto en nuestro país como en otros países de la Unión Europea (1). Entre 2017 y 2019 las notificaciones de desabastecimientos aumentaron un 60%; el 75% de los Estados Miembros opinan que el problema ha empeorado en el último año; y se han declarado desabastecimientos de antibióticos (como amoxicilina), tratamientos contra el cáncer, trombolíticos, insulina, antipiréticos, antihipertensivos, anestésicos y otros medicamentos esenciales (2).
En el artículo de Valladolid se menciona que estos desabastecimientos afectan con frecuencia a medicamentos “maduros”, de coste menor, pero muy efectivos. Esto, como veremos después, es muy importante de cara a la solución del problema. Entre tanto, un documento suscrito por 19 Estados Miembros de la UE, entre los que figuraba España, fechado el 2 de mayo de 2023, apuntaba las causas aparentes del problema y planteaba diversas medidas para paliar su impacto (3).
Entre las causas se citaba el aumento de la demanda, problemas de calidad, cierres o traslados de fábricas, fallos en las cadenas de suministro, problemas de regulación y de reembolso, y se llamaba la atención sobre la dependencia de China y de la India para el suministro de ingredientes farmacéuticos activos (60% del suministro total). También se ha alegado el impacto de la inflación o los costes energéticos y otros (4).
A lo largo de los últimos años los países y la Comisión Europea han tratado de llevar a cabo acciones para superar este problema. En la propuesta de modificación de la legislación farmacéutica europea, presentada en abril de 2023, la Comisión proponía algunas medidas, como exigir una notificación más temprana de la retirada de medicamentos del mercado, reforzar los planes de contingencia, incluyendo almacenamiento suficiente, etc. Así mismo, en el documento citado, los países firmantes plantean nuevas medidas: un mecanismo de solidaridad entre los Estados Miembros en casos de desabastecimiento; la elaboración de un listado de medicamentos críticos para reforzar las cadenas de producción y suministro; y una Ley de medicamentos críticos, para disminuir la dependencia exterior y garantizar la producción y suministro de materias primas y otros componentes.
En el mismo sentido, los europarlamentarios Susana Solís, Nicolás González y Dolors Montserrat (5) dirigieron una carta a la presidenta de la Comisión y a los comisarios de salud y de mercado interior, insistiendo en una Ley que permitiera aumentar la financiación para la investigación y producción de principios activos y medicamentos esenciales. Todas estas medidas pueden ser interesantes (siempre que se garantice la titularidad pública de los derechos de propiedad intelectual de cualquier producto en que haya habido financiación pública), pero no son suficientes, porque no corrigen la causa principal de los desabastecimientos.
Las causas aparentes de los desabastecimientos son varias, como ya se ha visto, e interactúan entre sí. Pero la causa más importante tiene que ver con un aspecto de la regulación que no se cita explícitamente: el modelo de fijación de precios para los nuevos medicamentos, basado en el poder del monopolio. En efecto, la legislación establece la concesión de monopolios a las empresas farmacéuticas, permitiendo que puedan fijar precios por encima del coste de fabricación y así poder recuperar los costes de la investigación realizada, más un beneficio razonable. El problema es que, al tratarse de un producto que tiene que ver con la salud, con el dolor, con la vida y la muerte, las empresas se ven tentadas de pedir precios muy por encima de los costes de fabricación y de investigación, logrando así beneficios muy por encima de lo razonable.
Si los laboratorios pueden fijar precios abusivos (100 veces por encima de los costes) para los nuevos fármacos, no tienen ningún interés en mantener los fármacos antiguos, que pueden ser muy eficaces, pero son mucho menos caros. Se retiran del mercado y se «desabastecen» alegando problemas de fabricación o de materias primas, etc. -“decisiones de tipo empresarial” (1)-, tratando de introducir nuevos medicamentos a precios mucho más rentables. Este problema se agudiza por la limitación de fabricación debida al monopolio u oligopolio (patentes y otras exclusividades) que impiden la fabricación de genéricos y biosimilares a otras empresas. Por lo tanto, para resolver los desabastecimientos la Comisión Europea debe plantearse la limitación o suspensión de la aplicación de patentes y otras exclusividades en medicamentos, retirando su apoyo a los monopolios y favoreciendo la competencia.
Es precisa y será bienvenida más inversión de la Unión Europea y de los países miembros en investigación y desarrollo de nuevos medicamentos, así como en la fabricación de principios activos y medicamentos críticos en los países de la Unión. Pero esa inversión pública debe incluir la exigencia de que el resultado de la misma (nuevos productos, etc.) sea de propiedad pública, y que los derechos de propiedad intelectual (patentes y otros), sean de titularidad pública, para favorecer licencias abiertas y la producción a precio de coste. Solo de esta manera se podrán conseguir precios asequibles, cercanos al coste, con márgenes de beneficio razonables. Y solo así será interesante para las empresas mantener en el mercado los productos actuales, a precios ajustados, logrando importantes volúmenes de venta, y permitiendo obtener unos beneficios suficientes para incentivar su continuidad. Si, por el contrario, se mantiene un modelo de precios abusivos, con la excusa de los gastos de investigación, dichos precios “expulsarán” sistemáticamente del mercado otros medicamentos eficaces y asequibles, generando desabastecimientos de productos esenciales una y otra vez.
Conviene insistir en que no es cierto que esos precios cercanos al coste no sean sostenibles. Con esos precios las empresas obtendrían un margen de beneficio sobre ventas similar al de otras empresas industriales no farmacéuticas, como ya hacían antes de generalizar las patentes de medicamentos con el Acuerdo sobre los Derechos de Propiedad Intelectual relacionados con el Comercio (ADPIC). Y si no hubiera empresas privadas dispuestas a fabricar estos productos, el sector público debería generar una infraestructura suficiente para garantizar la producción. El problema de fondo es que el modelo actual y la legislación europea permiten y fomentan precios abusivos para los nuevos medicamentos. Y esa circunstancia hace que “no sea rentable” fabricar productos a precios justos. Este es el modelo que debemos cambiar progresivamente. De lo contrario, los desabastecimientos seguirán penalizando a los pacientes afectando negativamente a su salud, y continuarán desangrando a los servicios sanitarios.
Referfencias
- https://accesojustomedicamento.org/revista-no-22-junio-2023/
- https://voxeurop.eu/en/health-why-europe-chronically-running-out-meds/
- https://www.politico.eu/wp-content/uploads/2023/05/02/Non-paper-security-of-medicines-supply-02.05.23.pdf
- https://www.politico.eu/article/health-care-pharma-why-is-europe-running-out-of-medicines-and-whats-being-done-about-it/
- https://mcusercontent.com/80a2795e9aa8aacac0c148b3b/files/f2739d11-975a-b735-a839-f6929f02fd6e/Gonzalez_Montserrat_Solis_CMA_082023.pdf