AUTOR: José María González Vigueras. Coordinador de Salud de OCU (Organización de Consumidores y Usuarios).
Revista Nº 18 – Febrero 2023
Entre las diversas áreas de actuación de OCU se encuentra la defensa de los derechos de los consumidores y usuarios en materia de Salud. Y dentro de este capítulo son diversas las acciones relacionadas con el acceso de los ciudadanos a los servicios sanitarios en condiciones de equidad y calidad. A este respecto, un tema sobre el que nos mostramos especialmente preocupados es el del acceso a los medicamentos a un precio justo, ya sea a través de reivindicaciones en solitario, en colaboración con otras organizaciones de consumidores europeas o con entidades con las que compartimos fines comunes, como la plataforma No Es Sano (en el seno de la cual trabajamos codo a codo con otras organizaciones del ámbito sociosanitario, como la Asociación Acceso Justo al Medicamento).
En este artículo repasamos algunas de las acciones más destacadas de OCU, y en concreto detallamos nuestro éxito más reciente, la sanción a la farmacéutica Leadiant por abuso de posición dominante, un caso que si bien afecta a pocos pacientes puede considerarse paradigmático de las peores maniobras de la industria farmacéutica.
Aspen y el caso Avastin/Lucentis
Una de estas acciones fue la denuncia contra la farmacéutica Aspen ante la Comisión Nacional de los Mercados y la Competencia (CNMC) por el encarecimiento injustificado de varios medicamentos contra el cáncer, que propició la apertura de un expediente sancionador(2). Un expediente que no llegó a materializarse en sanción dado que el caso se elevó finalmente a la Comisión Europea, ante la cual Aspen aceptó bajar los precios en un compromiso vinculante(3).
Otro caso escandaloso que fue denunciado por OCU fue el de Avastin/Lucentis, que lamentablemente no llegó a buen término en España pero que desembocó en multas millonarias(4) en Bélgica (contra Novartis), Italia (contra Novartis y Hoffmann-La Roche) y Francia (contra Novartis, Hoffmann-Roche y Genentech) por sus maniobras para fomentar el uso de Lucentis sobre el de Avastin. Ambas moléculas se utilizaban para el tratamiento de la degeneración macular asociada a la edad, pero en el caso de Lucentis a un precio cien veces más caro.
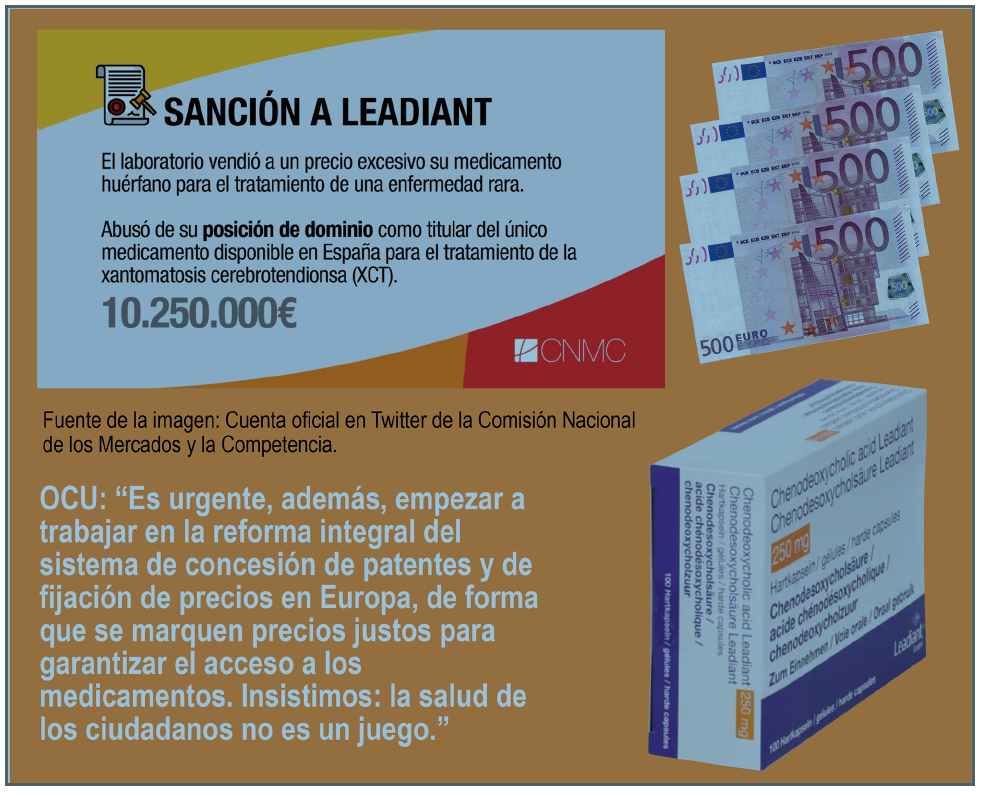
El caso Leadiant: historia de un abuso
Este caso se refiere al tratamiento con ácido quenodesoxicólico (AQDC) de los pacientes con xantomatosis cerebrotendinosa (XCT), un tratamiento que en nuestro país financia íntegramente el Sistema Nacional de Salud.
La XCT es una enfermedad rara de tipo metabólico, de las que unas 50 personas están diagnosticadas en España. Los primeros síntomas suelen presentarse en la infancia, pero el cuadro típico puede no ser evidente hasta la edad adulta. Los pacientes a menudo sufren diarrea crónica, desarrollan cataratas a una edad temprana y luego, progresivamente, problemas de salud de lo más variado: neurológicos y psiquiátricos (ataxia, deterioro cognitivo, epilepsia, parkinsonismo, demencia, etc.), hepáticos, cardiovasculares (arteriosclerosis), de absorción de nutrientes y óseos (osteoporosis, fracturas), etc.
La causa de esta enfermedad se encuentra en la ausencia de la enzima esterol 27-hidroxilasa, que interviene en el proceso de síntesis de los ácidos biliares. Debido a este fallo las personas con XCT tienen déficit de ácidos biliares y exceso de las sustancias precursoras, el colesterol y el colestanol. Ambas se van depositando como acúmulos de grasa o xantomas por todo el cuerpo, especialmente en el sistema nervioso central, tendones, piel, pulmones y huesos. La enfermedad no tiene cura, pero puede tratarse con 250 mg de AQDC administrado 3 veces al día, lo que ralentiza la progresión y mejora los síntomas.
Este fármaco, de suministro hospitalario, multiplicó su precio desde los 0,15 euros que costaba una cápsula en 2008 hasta los 146,18 que costaba en 2017: el precio se multiplicó por mil.
¿Cómo se llegó a esta situación? El AQDC es un principio activo antiguo que no estaba protegido por una patente. Originalmente estaba autorizado para el tratamiento de los cálculos biliares, pero a mediados de los años 80 se comprobó que, en personas con XCT, el AQDC normalizaba los niveles de colestanol y era eficaz contra los síntomas de la enfermedad. A partir de entonces se empezó a utilizar en estos pacientes fuera de la indicación autorizada (uso off label).
En los años 70 varios laboratorios lo comercializaban para los cálculos biliares. En España se vendía con dos nombres: Quenobilan (de laboratorios Estedi) y Quenocol (de Zambon). Otras marcas fuera de nuestras fronteras eran Chenofalk (de laboratorios Dr Falk Pharma), Chenix (de laboratorios Solvay) o Xenbilox (de Sigma-Tau, laboratorio que luego cambió su nombre a Leadiant). Pero todas estas marcas desaparecieron del mercado, en algunos casos por razones de desinterés comercial de la propia compañía y en otros casos como resultado de una operación estratégica de Leadiant para hacerse con todo el mercado. De hecho, este laboratorio adquirió los derechos y autorización de comercialización de Chenofalk y Chenix entre 2008 y 2009.
Leadiant, por aquel entonces aun Sigma-Tau, entretanto, consiguió que en 2014 la Comisión Europea aceptara su solicitud y designara al AQDC como medicamento huérfano, apto para el tratamiento de una enfermedad rara. El interés de Leadiant en lograr esa denominación radicaba en las ventajas que la normativa de la Unión Europea (UE) concede a quienes fabrican estos medicamentos. La más importante, los 10 años de exclusividad para comercializar el fármaco en toda la UE, una vez que este es autorizado.
Tres años después, en 2017, Leadiant presentó una solicitud a la Agencia Europea del Medicamento (EMA) para que autorizara el uso del AQDC para la nueva indicación, tratar la xantomatosis cerebrotendinosa. Dicha autorización se aprobó, y de esta forma Leadiant pasó a ser el único autorizado para comercializar en exclusiva, hasta 2027, AQDC en el mercado europeo para la indicación de XCT.
España no era una excepción. Pese a que habían dejado de comercializarse los medicamentos a base de AQDC para tratar los cálculos biliares, en nuestro país se hacía todo lo posible para mantener el tratamiento a los enfermos con XCT. Por ejemplo, hasta junio de 2017 en España se estuvo importando desde Alemania bajo la marca Xenbilox. Como ya hemos comentado, todo terminó cuando Leadiant lo retiró del mercado. Su estrategia fue cambiarle el nombre y el precio: de Xenbilox pasó a llamarse Ácido quenodesoxicólico-Leadiant. Y el envase de 100 cápsulas, de 3.903 euros pasó a costar 14.618 euros (casi cuatro veces más). Una gran jugada, que permite obtener una extraordinaria rentabilidad.
Cuando Xenbilox desapareció los diferentes países afectados utilizaron otra baza para reducir costes: prepararlo ellos mismos como fórmula magistral en los servicios de farmacia hospitalaria. Dependiendo del hospital, el envase de 100 cápsulas podía costar entre 151-450 euros, muy barato, pero es que también lo era la materia prima, ya que el AQDC se elabora a partir de los ácidos biliares del buey. Esa vía, sin embargo, quedó también paralizada. Leadiant, en su afán por proteger su negocio por todos los medios, solicitó a las autoridades inspecciones que concluyeron que la materia prima contenía impurezas por encima de las permitidas por la Farmacopea Europea, de esta manera se consiguió interrumpir la elaboración de la fórmula magistral en Países Bajos y en Bélgica.
En junio 2021 la compañía, tras solicitar al Ministerio de Sanidad comercializar AQDC-Leadiant en España (hasta entonces se había estado proveyendo vía “medicamento extranjero”) consiguió que la Comisión Interministerial de Precios de Medicamentos aprobara la financiación de este medicamento con un precio de venta de laboratorio de 14.000 euros por envase de 100 cápsulas.
La denuncia de OCU
A juicio de OCU, Leadiant se ha aprovechado del sistema de incentivos para medicamentos huérfanos. Las ventajas regulatorias y los 10 años de exclusividad de mercado son para que la industria farmacéutica invierta en investigar y desarrollar medicamentos para enfermedades que afectan a muy pocos pacientes y que, por tanto, son poco rentables económicamente. Pero en este caso, OCU considera que el laboratorio aprovechó un defecto de la norma para crear un monopolio en torno a un medicamento antiguo, de eficacia y seguridad ya conocida, que se venía usando con normalidad para tratar una enfermedad rara. Leadiant no ha invertido en I+D y definitivamente la naturaleza de la materia prima difícilmente justifica el extraordinario incremento del precio.
Por eso, OCU presentó en 2019(5) muna denuncia contra Leadiant ante la CNMC, denuncia que finalmente derivó el pasado mes de noviembre en la imposición de una multa de 10.250.000 euros por abuso de posición dominante(6). Y no hemos sido los únicos: denuncias similares tuvieron lugar en Países Bajos(7) e Italia(8), resultando en multas de 19,5 millones y 3,5 millones de euros, respectivamente.
Una reflexión final: Urge cambiar el sistema
La función de los gobiernos es defender el interés general y garantizar el acceso de la población a los medicamentos que precise, así como asegurar la sostenibilidad del sistema público. Es inadmisible que se comprometa el presupuesto público destinado al gasto farmacéutico y se juegue con la salud de los españoles.
Es por eso que desde OCU pedimos que:
– Se modifique el sistema de incentivos de los medicamentos huérfanos para que no vuelvan a darse casos como este u otros similares.
– Los estados hagan valer su capacidad de compra para rechazar propuestas abusivas de los laboratorios y negociar precios razonables.
– Se fomenten las compras centralizadas de nuevos fármacos a nivel europeo, para conseguir una fuerza de negociación aún mayor.
– En casos concretos, podría incluso promoverse la emisión de licencias obligatorias que permitan su fabricación como genéricos, algo totalmente legal en caso de necesidad por razones de salud pública.
– Es urgente, además, empezar a trabajar en la reforma integral del sistema de concesión de patentes y de fijación de precios en Europa, de forma que se marquen precios justos para garantizar el acceso a los medicamentos. Insistimos: la salud de los ciudadanos no es un juego.
Referencias
1.- Memoria OCU 2021: https://www.ocu.org/info/memoria-ocu
2.- Aspen investigada por la CNMC: https://www.ocu.org/salud/derechos-paciente/noticias/competencia-abre-expediente-a-aspen
3.- La Comisión Europea acepta los compromisos contraídos por Aspen: https://ec.europa.eu/commission/presscorner/detail/es/ip_21_524
4.- Multas europeas a Novartis: https://www.ocu.org/salud/medicamentos/noticias/avastin-lucentis-multa-francia
5.- OCU denuncia a Leadiant ante la CNMC: https://www.ocu.org/organizacion/prensa/notas-de-prensa/2019/denuncialeadiant240619
6.- La CNMC multa a Leadiant: https://www.cnmc.es/prensa/sancionador-leadiant-20221114
7.- La autoridad neerlandesa de la competencia multa a Leadiant: https://www.acm.nl/en/publications/acm-imposes-fine-drug-manufacturer-leadiant-cdcas-excessive-price
8.- La autoridad italiana de la competencia multa a Leadiant: https://en.agcm.it/en/media/press-releases/2022/5/A524?_ga=2.228453662.226647881.1677489730-2088998707.1650445175
