- Ascenso y descenso de la evaluación de medicamentos en España
ORIGINAL. Revista nº 39 – Mayo 2025.
Emilio Jesús Alegre del Rey.
Farmacéutico. Hospital Universitario Puerto Real.
Introducción
Siempre me he sentido orgulloso de la sanidad pública española. Cuando aún era residente del Doce, a principios de los 90, dispensaba los carísimos fármacos del VIH a chavales de zonas muy pobres y eso me hacía pensar que teníamos una sociedad civilizada, solidaria y con capacidad de grandes logros, de los que realmente importan. Mis primeros años en la Atención Primaria andaluza, a finales de la misma década, me permitieron admirar este sistema que pivotaba sobre la prevención, facilitaba diagnósticos tempranos y constituía la piedra angular de un sistema sanitario envidiable.
Sin embargo, desde el cambio de milenio hasta aquí, mientras las innovaciones técnicas han sido notorias y la demanda ha aumentado enormemente por una pirámide de población envejecida, he visto decadencia, inversiones insuficientes y descompensadas y una lenta pero constante degradación de la atención sanitaria, como si no fuéramos capaces de mantener la herencia que tanto costó construir. Esta ponía en práctica una profunda y antigua convicción moral del pueblo español: la atención sanitaria al que no puede pagársela es un deber de justicia, basado en la dignidad de la persona.
Creo que la “Ley de los Medicamentos”[i] es un paso más en este lento declive de la sanidad española. Para cualquier sistema sanitario público, hoy día, es importante incorporar de forma racional —juiciosa, inteligente— los nuevos medicamentos, de forma que sirvan a los pacientes, que se utilicen solo en aquellos que realmente obtendrán un beneficio relevante con su uso y no sean dirigidos sobre todo por la promoción publicitaria, con intereses económicos espurios. La peor ineficiencia resulta de no evaluar, de no gestionar bien, de no invertir selectivamente los recursos que se obtienen con los impuestos de todos.
Pero el mayor temor de una industria farmacéutica miope es precisamente la evaluación. O mejor dicho, más que la evaluación: la toma de decisiones posteriores basadas en ella, el posicionamiento terapéutico, lo que empezó a hacer el NICE ya hace dos décadas con su financiación selectiva y sus esquemas de acceso de pacientes. No han conseguido derribarlo por mucho que lo han intentado, algo que sí hicieron con la evaluación del Infarmed portugués, con la inestimable ayuda de la oposición política[ii].
En este tiempo, he observado que ese sector miope de la industria farmacéutica —no de toda— teme sobre todo dos cosas: (1) la evaluación-posicionamiento post-regulatorio y (2) los informes públicos y no sesgados de coste utilidad. La evaluación y el posicionamiento multidisciplinar exponen la utilidad comparativa de los medicamentos y especifican la población diana que se podría beneficiar de ellos, limitando la influencia promocional. Por su parte, las evaluaciones económicas públicas y transparentes evidencian la injusticia de ciertas pretensiones económicas, a todas luces excesivas. Podrían cambiar el sentido de la presión social, orientándola hacia la exigencia de un acceso justo a aquellos nuevos fármacos que aporten beneficios reales a los pacientes, y dificultando que la negociación de precios se convierta en una imposición unilateral al sistema sanitario público.
La industria farmacéutica es crucial para Europa y es muy importante cuidarla, pero también es importante establecer unas reglas de juego sanas y claras a favor del bien común, y mantenerlas en el tiempo con acuerdos políticos. Eso beneficiaría tanto a la sociedad como al desarrollo de la propia industria, cuya base ética y de negocio no puede ser otra cosa que sanitaria. Solo si somos exigentes con los fármacos por los que pagamos, la industria invertirá en lo que realmente nos ofrece beneficio, y eso no es ni la promoción omnipresente, ni los KOL platino[iii], ni nuevos fármacos cuyos informes necesitan mucha cirugía estética para que parezca que aportan algo.
Sin embargo, de vez en cuando los servidores públicos sucumben a la idea mesiánica de que con la industria es mejor aliarse y evitar tensiones. Y es que para el Ministerio de Sanidad y los gestores autonómicos, sostener una línea clara en política farmacéutica basada en la evaluación, el posicionamiento multidisciplinar, el estudio económico y la financiación selectiva puede ser muy costoso políticamente, por la presión mediática dirigida. La manipulación que se hizo en España a partir del informe W.A.I.T., un análisis simplista —como mostraron nuestros compañeros[iv]— sobre el acceso de los nuevos fármacos al mercado, ya se hizo contra el NICE hace dos décadas —informe del Instituto Karolinska, financiado por Roche[v]—. En Reino Unido suscitó discusiones pero no caló; aquí ha calado porque nuestra política y medios de comunicación presentan un nivel diferente. A nivel político, las ventajas inmediatas de seguirle el juego a la industria son suculentas y aparentemente inocuas, como lo son las ganancias de los KOL —“key opinión leaders” sostenidos económicamente por la industria— a nivel sanitario. Pero siempre hay contrapartidas poco evidentes: la contrapartida política es desactivar la evaluación-posicionamiento y olvidar la publicación de estudios económicos, como se estaba empezando a realizar con los IPT. Eso tiene un coste que impedirá dar respuesta a un reto fundamental, que es incorporar racional y eficientemente los nuevos medicamentos.
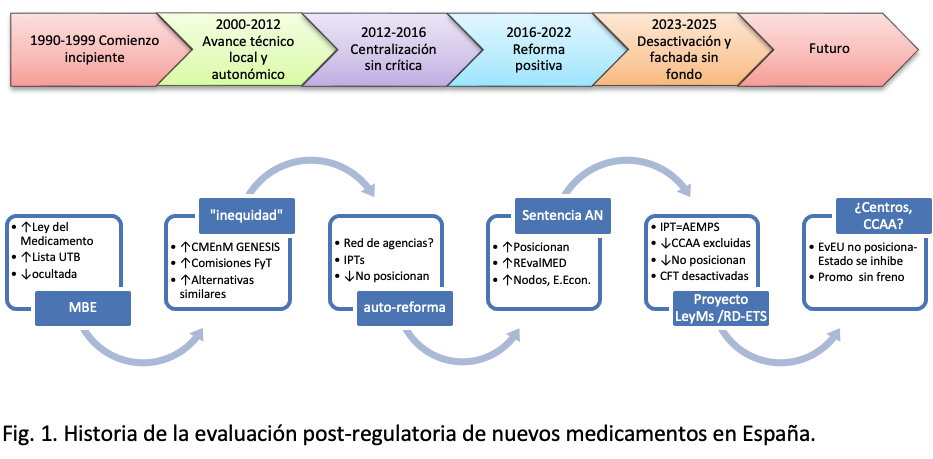
Historia profunda de la evaluación de nuevos medicamentos en España
1- Los inicios (1994-1999)
La Ley del Medicamento (1990)[i] de nuestro compañero Joaquín Bonal fue un hito tras décadas de proteccionismo nacional con bajos estándares, porque exigió ensayos clínicos para los nuevos medicamentos. Francia llevaba cerca de dos décadas haciéndolo. Por tanto, en ese momento, el Catálogo de Especialidades Farmacéuticas español estaba plagado de medicamentos carentes de evidencia suficiente —desde reserpina para la tensión hasta triflusal, el antiagregante español, mucho más caro que la aspirina—. El Ministerio/INSALUD reunió a un grupo multidisciplinar de facultativos para hacer la necesaria criba. Conocí a dos de sus miembros, y trabajaron arduamente para presentar su informe: un listado de medicamentos de “Utilidad Terapéutica Baja (UTB)”[ii] o “Valor Intrínseco no Elevado” (VINE) —les sonará a los más viejos, como yo—.
Creo que aquel fue un estimulante principio para la evaluación post-regulatoria en España, pero sucumbió pronto: la industria se lo cambió al Ministerio por una rebaja del 3% en el precio de los medicamentos[iii], a cambio de guardar el listado en un cajón. “Nada nuevo bajo el sol”. Algún miembro de aquella comisión evaluadora no se sometió y filtró la lista; muchos la teníamos fotocopiada con el marchamo de “confidencial”. Pero aquellos medicamentos siguieron prescribiéndose con cargo a la sanidad pública hasta el “medicamentazo”[iv] de Aznar en 1998, absurdamente contrarrestado por Chaves en Andalucía.
2 –Grandes avances en evaluación (2000-2012)
Corrían tiempos de apertura; el Ministerio acogía la autocrítica: su revista, Información Terapéutica del Sistema Nacional de Salud, evaluaba anualmente los nuevos tratamientos autorizados, reconociendo que cerca de la mitad no aportaban nada[i]. Pero, por dentro, la oposición antievaluadora hacía su trabajo. Dos farmacéuticas elaboraban parcos informes para unas mil especialidades incorporadas al año; su capacidad técnica y criterio eran encomiables, pero el equipo estaba llamativamente infradimensionado. Todo se financiaba. Así seguiría mucho tiempo, con Carlos Lens (2012-2018), hasta que Patricia Lacruz y Dolores Fraga llegaron al Ministerio.
Sin embargo, como muchos gestores y sanitarios entendíamos que no se podía dejar la incorporación de la innovación bajo la influencia de una promoción industrial sin contrapesos, los avances evaluadores se sucedían aguas abajo en el sistema sanitario. Tras el florecimiento, en los ‘90, de la “Medicina Basada en la Evidencia”, sobre todo en atención primaria, y el desarrollo progresivo de las Comisiones de Farmacia amparadas por la Ley del Medicamento en hospitales —buenas leyes ayudan a progresar—, varios grupos profesionales establecieron sistemas bien ajustados para la evaluación post-regulatoria y selección de los nuevos medicamentos. En primaria, el Comité Mixto para la Evaluación de Nuevos Medicamentos (CMEnM), integrado por centros de información de medicamentos autonómicos de elevada competencia científica, elaboraba “fichas de novedad terapéutica” de cada nuevo fármaco, especificando y calificando su utilidad comparativa con el tratamiento habitual[ii]. El grupo GENESIS, de la Sociedad Española de Farmacia Hospitalaria, constituyó un grupo colaborativo donde farmacéuticos de toda España compartían en abierto evaluaciones con un sistema riguroso y estandarizado, que se presentaban en las comisiones de farmacia hospitalarias. Al final de este período, la mayoría de los hospitales incorporaban crítica y selectivamente los medicamentos, basándose en sus informes[iii].
Por otra parte, con los “me too” —nuevos medicamentos similares a otros ya comercializados—, los hospitales empezaron a aplicar políticas de “alternativas terapéuticas equivalentes”[iv]: entre dos opciones de similar beneficio clínico, lo más razonable y justo es usar la de menor coste. Eso introdujo competencia y bajadas de precios entre fármacos muy caros bajo patente, algo muy útil para la incorporación de biológicos en psoriasis, artritis reumatoide, y más tarde en asma, dermatitis atópica, etc. En primaria, la prescripción por principio activo, más adecuada científicamente y limpia —desligada de la marca comercial—, ya había avanzado en el mismo sentido. Las plantillas comerciales de la industria se resintieron, pero la sanidad ganó. Más adelante llegarían al hospital los biosimilares. Un artículo sobre el control presupuestario en el NHS destacaba la importancia de todas estas políticas de competencia de precios para gestionar bien la inversión en farmacia[v].
La industria, atrapada como Roma en una hispánica guerra de guerrillas autonómica y local, no lograba que su gran inversión promocional diera sus frutos. Los fármacos eran incorporados selectivamente en hospitales, y en primaria las falsas novedades encallaban en indicadores de prescripción como el de “novedades terapéuticas no recomendadas”[vi], el indicador más pedagógico que he visto. Este, por cierto, desapareció por orden política sin discusión posible. Estaba yo entonces en la implementación de aquellos indicadores y me transmitieron que “la decisión venía de arriba”: Roma locuta, causa finita. Eran tiempos de Bernat Soria (2009). El ideal de “llevarse bien con la industria” —entiéndaseme— empezaba a reaparecer, pero aquello fue aún esporádico.
3 – La evaluación, centralizada y desactivada (2012-216)
Entre aquellas dificultades para la industria, alguien debió barruntar la solución. En los encuentros financiados, publicados luego profusamente en sus medios afines, no se hablaba de otra cosa: la inequidad. Resultaba intolerable para los pacientes que unos fármacos fueran restringidos en unos hospitales y en otros no. Es cierto, el sistema no era perfecto[i], pero en lo que importa al paciente, no se restringían fármacos que aportaban beneficios clínicos reales, sino productos fallidos como el carísimo bevacizumab en cáncer de mama, que no aportaba nada y tuvo que ser suspendido por la FDA[ii]. También se usaban fármacos más económicos, pero igualmente eficaces y seguros.
Los “Informes de Posicionamiento Terapéutico” aportaron la solución, varios años después. El nuevo mensaje de “evitar las evaluaciones paralelas”, obedeció a una nueva dirección desde la industria: “informes sí, pero que los haga la AEMPS”. No les faltaba razón estratégica para ello. La misma entidad que autorizaba y redactaba las indicaciones no iba a añadir restricciones ni criticar la evidencia que había sostenido sus propias decisiones. La inanidad de las conclusiones de aquellos primeros IPT lo refleja de forma llamativa —ver ejemplo en cuadro adjunto—[iv]. Pero, aun con informes de posicionamiento que no posicionaban, la evaluación hospitalaria, local, comenzó a desactivarse. Algunos farmacéuticos abogaron por reconvertirse en “facilitadores” del medicamento, lo cual asegura menos conflictos y más satisfacciones. La destrucción de la evaluación a manos de la promoción parecía consumarse.
4 – Auto-reforma de los IPT desde dentro y REvalMED (2016-2022)
Había dos felices errores en toda esa estrategia antievaluadora: uno, que se había introducido la palabra “posicionamiento” en el título de los informes: posicionar no es solo presentar y analizar la evidencia; supone partir de ahí para especificar el lugar en terapéutica recomendable para el fármaco: para qué pacientes y en qué lugar de prioridad frente al tratamiento habitual —¿preferente, equivalente, postergado?—[i]. Otro error afortunado fue el segundo: de nuevo, no se había contado con los efectos de la plural idiosincrasia hispánica, y las Comunidades Autónomas participaban con sus expertos, todos con abundante experiencia evaluadora en el sistema sanitario, que hicieron buen equipo y se complementaron con técnicos de la Agencia independientes y preparados, aun con perspectivas distintas. Los informes de posicionamiento empezaron a posicionar de forma consensuada. Para muchos fármacos se especificaba en qué pacientes eran más beneficiosos que el estándar y en cuales no —escenario de utilidad—[ii]. Otros productos fueron rechazados y no se financiaron, como el famoso atalureno[iii], que nunca debió autorizarse y debería estar ya retirado, o ixazomib para mieloma, cuya única bondad era la administración oral, buen reclamo comercial pero no tanto sanitario cuando la eficacia no acompaña[iv].
Aquel importante avance en los IPT, que sorprendió a muchos, convivió en el tiempo con un relajamiento en las políticas de exigencia de estudios en la EMA, bajo el lema de la “aprobación acelerada” y “facilitar el acceso” de los medicamentos al mercado —no de los pacientes a los medicamentos que necesitan, nótese el matiz—. Desde entonces, a menudo ya no se exigen ensayos clínicos aleatorizados, basta con estudios de fase II con un solo brazo. Eso, que en principio iba a ser solo para fármacos con una primera evidencia drástica de eficacia en situaciones graves sin alternativas adecuadas —como fue sofosbuvir en hepatitis C—, acabó estableciéndose para situaciones menos especiales, y para determinadas enfermedades crónicas, y para la vecina del quinto. Además, las autorizaciones condicionales eran en la práctica definitivas. Así ocurrió precisamente con atalureno o ixazomib; que el estudio pedido fracasara no se traducía en revocación de la autorización; al fin y al cabo, que un mal resultado no estropee un buen fármaco.
Con este declive de rigor evaluador regulatorio, la evaluación afinada de los IPT era cada vez más necesaria y utilizada, tanto para la financiación pública en la Comisión Interministerial de Precios de Medicamentos, como para el posicionamiento efectivo en los hospitales, aunque esto de forma parcial y desigual —no se tomó Zamora en una hora, todo esto es difícil y complejo, y las CCAA, salvo excepciones como Cataluña, tenían una asignatura pendiente en la implementación homogénea de las decisiones en sus hospitales y centros de salud—.
Pero aquello empezaba a funcionar, y desde un Ministerio ahora realmente independiente, con el tándem Patricia Lacruz – Dolores Fraga se potenció y se le quiso dar solidez, mediante el Plan de consolidación de los IPT[v]. Con la creación de REvalMED, se formaron nodos multidisciplinares para supervisar los informes y se incluyeron estudios económicos. Ambos eran grandes avances pero a la vez retos difíciles, que necesitaban una inversión que no llegaba y carecieron del tiempo suficiente para madurar. Con una valoración positiva de lo que se estaba haciendo, el Comité Asesor para la Financiación de la Prestación Farmacéutica del SNS, con ayuda de un grupo multidisciplinar de evaluadores clínicos y economistas de la salud, presentó sus recomendaciones para una evolución del sistema evaluador y decisor
5 – La destrucción de la evaluación pública(2022 – actualidad)
La política farmacéutica dio un giro de 180o con la entrada de César Hernández a la Dirección General, proveniente de la AEMPS. Farmaindustria había llevado a los tribunales el sistema de los IPT, con base regulatoria insuficientemente desarrollada, y el Ministerio lo dejó caer. Luego, en vez de reformarlo y darle solidez, lo desactivó y entregó en exclusiva los IPT a la AEMPS, esta vez sin participación autonómica, en espera de una evaluación europea centralizada en la que participa la propia AEMPS[i]. Para acabar con una iniciativa como los IPT hay algo peor que eliminarla, peor que destruir su metodología y su esencia crítica: mantener su nombre y su apariencia. Los IPT han vuelto a 2013: ya no posicionan, todo es útil en su indicación sin más. Se inactivó la evaluación post-autorización[ii], a manos de la misma agencia que realiza la evaluación pre-autorización, con la excusa de esperar a las evaluaciones europeas. El RD-ETS[iii] consolidará este grave retroceso[iv] y no cabe esperar milagros de última hora, porque esta es de esas raras cosas en las que la oposición está de acuerdo sin que se note demasiado. Así que las CCAA esperan en silencio las evaluaciones europeas.
Dichas evaluaciones europeas no aportarán recomendaciones de posicionamiento, obviamente. Justificadas como un recurso útil para los numerosos países que no cuentan con una evaluación propia consolidada, dejan explícitamente a los países miembros la misión de extraer y aplicar conclusiones del informe[v]. EL RD-ETS, sobreinterpretando una de las recomendaciones del CAPF, —separar la evaluación (farmacoclínica y económica) de la decisión (de precio y financiación)24—, renuncia a las valoraciones sobre el escenario de utilidad de los nuevos medicamentos, y esto reduce la evaluación a mero ejercicio informativo, resumen de la evaluación regulatoria.
Este es el contexto en el que se presenta la nueva Ley de los Medicamentos. La situación de la evaluación post-regulatoria es la peor de los últimos 25 años: la estatal está desactivada, pero subsiste nominalmente, lo que resta solidez legal a las evaluaciones autonómicas y locales. La evaluación en farmacia hospitalaria y comisiones locales está casi desaparecida, con la excepción de las evaluaciones propias de GENESIS y GHEMA, el grupo andaluz de evaluación hospitalaria, que tampoco pasa por su mejor momento. Solo Cataluña, que insistió en consolidar un sistema de evaluación propio y bien diseñado mientras participaba en los IPT, parece haber acertado. A veces el que desconfía acierta, pero no es buen síntoma.
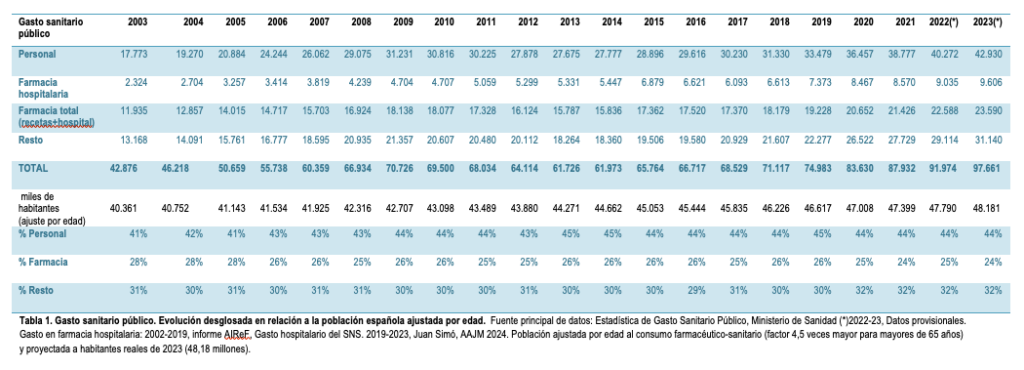
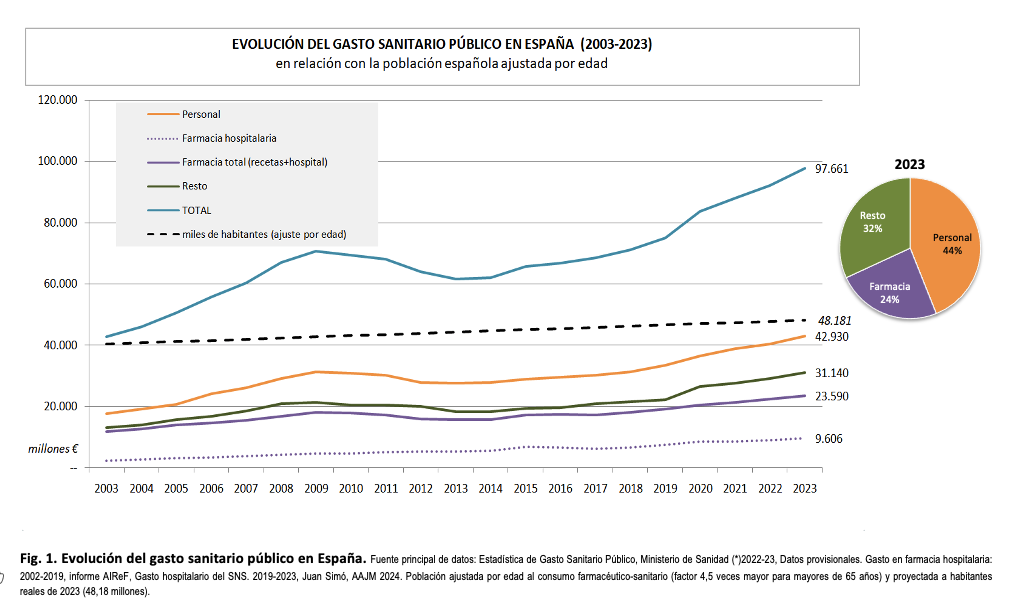
El farmacocentrismo, una lacra
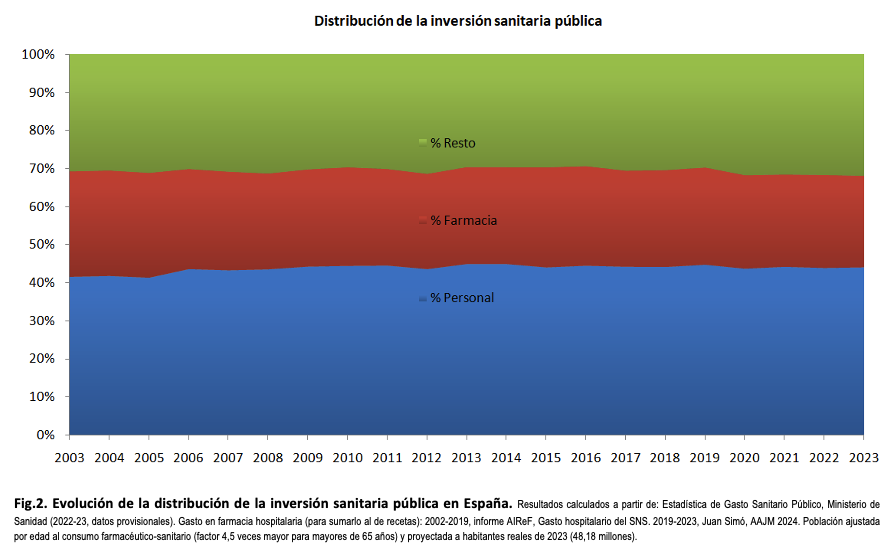
Antes de valorar el anteproyecto de Ley de los Medicamentos, hay que situarse en una perspectiva sanitaria más amplia. La política farmacéutica no es la clave del sistema sanitario, ni el gasto farmacéutico es el condicionante principal de su sostenibilidad, aunque sea muy importante (ver tabla 3 y figuras 2 y 3 en el anexo). La clave es decidir en qué se invierten esfuerzos y recursos, en dónde se ponen las prioridades para beneficiar a los pacientes. Incluso en las mejores épocas para la política farmacéutica, el sistema se ha resentido por un desarrollo descompensado, farmacocéntrico, de forma que son los nuevos medicamentos y su promoción los que dictan la atención y la agenda de gestores y clínicos. Parte del problema reside en que es más fácil, cuantificable e inmediato expresar el beneficio de un nuevo medicamento anticanceroso que expresar el beneficio de los cuidados paliativos, o de una atención clínica multidisciplinar para solucionar problemas que va causando el tumor en su progresión, o de la adecuación de plantillas. Por tanto, no financiar el medicamento puede traer problemas de opinión pública a corto plazo, lo otro no. Tal vez por eso gastamos millonadas en mejorar dos o tres meses la supervivencia, mientras seguimos con unos cuidados paliativos infradimensionados. Otra parte del problema es directamente la inyección de millones de euros para que se preste atención privilegiada al nuevo medicamento.
La gestión sanitaria y la atención médica han de estar centradas en las necesidades del paciente, establecer con ellas sus prioridades, y no estar continuamente atendiendo al nuevo fármaco de turno. Es más importante ajustar las plantillas sanitarias según progresa la envejecida pirámide demográfica que financiar hasta el último fármaco. Se da la incongruencia de que a menudo hay personal suficiente para prescribir el fármaco, pero no para realizar un seguimiento adecuado de ese tratamiento con posterioridad. Sin embargo, es el nuevo fármaco el que financia congresos, investigación, publicaciones, equipamientos, formación —incluso dentro de los centros públicos y a los residentes—. La industria farmacéutica es en realidad quien marca las agendas de la atención sanitaria pública, y esto es perjudicial de los pacientes.
El problema no es ya siquiera que la innovación sea demasiado cara. El problema es que la promoción con intereses económicos, si carece de contrapesos, emponzoña todo el sistema, y los fármacos acaban convertidos en algo mucho más complejo que una herramienta sanitaria al servicio del paciente, que es lo que son. Ante esto, las propuestas políticas maximalistas de eliminar toda promoción ligada a los medicamentos se quedan en papel mojado[i] si el sistema sanitario no se atreve a dar el paso adelante de asumir la financiación de formación e investigación auténticas e independientes.
Análisis del Anteproyecto de Ley de los Medicamentos
Con todo lo anterior, se entienden las recomendaciones fundamentales que el CAPF hizo en 2021[ii], 2022[iii] y 202324, que podrían haber guiado la nueva regulación que se proyecta. Las más importantes parecen las referidas en la tabla 2.
Tabla 2. Valoración de los aspectos principales del SPL que afectarán a la evaluación y posicionamiento de nuevos medicamentos en España. Referencias a documentos del CAPF de 202233 (A), 202324 (B) y 202132 (C).
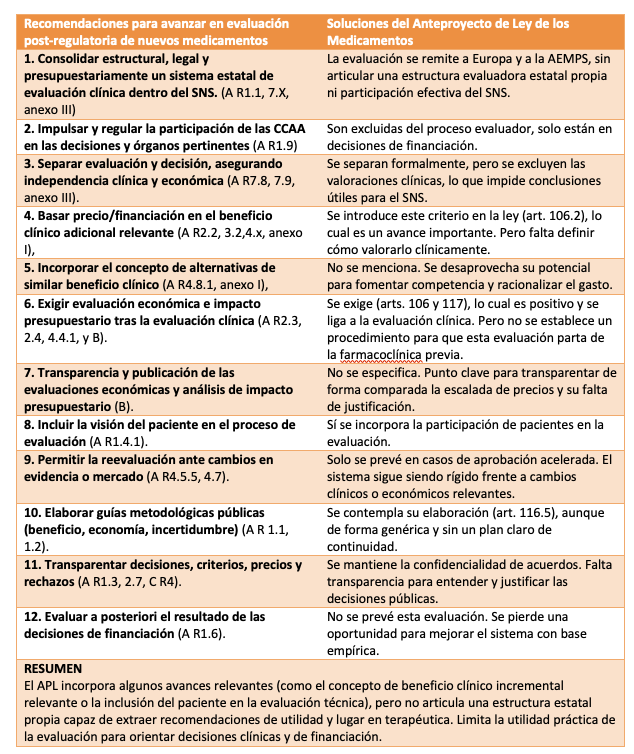
Estas doce medidas y otras habrían hecho progresar mucho la incorporación racional del los nuevos medicamentos en el SNS. Sin embargo, lo que aporta el anteproyecto de Ley en esos 12 puntos es sustancial y estratégicamente distinto, como se refleja en la propia tabla y comentamos a continuación.
La evaluación estatal no se articula como función propia, sino que se remite a la evaluación clínica europea prevista en el Reglamento (UE) 2021/2282, que no incluirá recomendaciones clínicas. El anteproyecto encarrila la entrega exclusiva de la evaluación post-regulatoria al evaluador regulatorio (AEMPS), consolidando su papel técnico sin contrapeso evaluador alguno.
- Las CCAA se han excluido del proceso evaluador. Solo están presentes en la financiación. Así, la participación de las CCAA y del propio Sistema Nacional de Salud se limita a funciones de revisión o consulta a través de expertos bajo la selección y dirección de la AEMPS, pero revisar no es participar: no hay intervención sustantiva ni capacidad propia de evaluación clínica. Se desmantela así, de facto, cualquier posibilidad de una evaluación estatal independiente del regulador e insertada en el SNS. España, con una gran capacidad evaluadora demostrada en su propio SNS, quedaría sin estructura evaluadora clínica propia en el escenario post-regulatorio.
- Formalmente se separa evaluación y decisión, pero se lleva al extremo de excluir toda recomendación sobre el lugar terapéutico de los medicamentos, que tampoco se hará en la evaluación europea. Esto, bajo pretexto de alinearse con el Reglamento europeo, hace realmente lo contrario: una dejación de las funciones estatales de extraer conclusiones para el SNS (ver texto adjunto). Con ello, las decisiones de posicionamiento —de naturaleza a veces económica y política, pero con base necesariamente clínica y científica— quedarían si existen, exclusivamente a criterio político.
- El concepto de “beneficio clínico incremental relevante” sí se introduce como criterio de financiación en el artículo 106.2 de la Ley. Es un paso adelante importante, pero exige una valoración que no encontraría sitio en el sistema diseñado por la ley.
- No se menciona el concepto de “alternativas terapéuticas de similar beneficio clínico”, carencia que afecta a la evaluación y el posicionamiento y dificulta la generación de competencia razonable de precios ante beneficios similares.
- Sí se refiere como criterio de financiación el coste-efectividad y el impacto presupuestario, con obligación del solicitante de presentar los estudios (art. 117.3). Estos se deben ajustar al beneficio clínico incremental relevante antes determinado (art. 106, 2d). Esto último sería un gran avance, pero la ley no diseña el marco adecuado para recomendar el escenario de utilidad y valorar clínicamente el beneficio. Así, se corre el grave peligro de asumir que cualquier beneficio es relevante y que la indicación autorizada define por sí sola el escenario de utilidad.
- No se menciona la transparencia de las evaluaciones económicas y de impacto presupuestario. Este es un punto clave para que la opinión pública conozca los precios.
- Sí se incluye a pacientes en el proceso de evaluación, lo cual es positivo.
- No se establece un procedimiento de reevaluación de precio y financiación ante cambios en el escenario y arsenal terapéutico, salvo para los casos de aprobación acelerada (art. 106.9). Esto genera un sistema inflexible a evidencias que dejan obsoletas ciertas opciones, y frente al desplazamiento del consumo a productos más caros que quedan bajo patente, frente a los que quedan sin promoción.
- La posibilidad de realizar guías metodológicas para las evaluaciones solo se menciona inespecíficamente. Art 116.5. Recordemos que el CAPF recomendó una guía de evaluación económica —y lideró su elaboración[i]— otra para la valoración del beneficio clínico adicional relevante, una tercera sobre incertidumbre y otras dos sobre impacto presupuestario y acuerdos innovadores de financiación.
- Se mantiene la confidencialidad de los acuerdos de financiación (Exposición de motivos, VIII). Para el sistema sanitario y la ciudadanía, sería importante conocer lo que se financia, por qué y a qué precio, y lo que no se financia, por qué y qué precio se pedía. La falta de transparencia no solo esconde acuerdos favorables para el SNS, sino también exigencias injustas de precio que deberían pasar factura social a la industria.
- No se hace referencia a evaluaciones a posteriori de las decisiones de financiación.
El problema no es solo que este sistema desmantelará de facto la evaluación crítica post-regulatoria en España, sino que al mantener un sistema solo formal pero irreal, desincentivará y dificultará la toma de decisiones a niveles inferiores del SNS, para hacer frente a esa omisión.
El futuro de la evaluación post-regulatoria en España
Es muy difícil imaginar cómo los profesionales del SNS van a enfrentar este importante reto y restaurar la evaluación de nuevos medicamentos, pero la historia nos enseña que el futuro no está tan escrito como pueda parecer. La nueva ley, a la vez que limita y malogra los avances, incorpora criterios clave que podrían desarrollarse, como la valoración del beneficio clínico incremental relevante, así como la exigencia de ajustar la valoración económica a una valoración clínica previa.
Ante esto, la evaluación crítica de grupos como GENESIS (SEFH) será particularmente valiosa, y la sociedad civil tendrá que afrontar nuevos retos en la exigencia de independencia en la toma de decisiones clínicas a profesionales y sociedades. La responsabilidad de evaluar recaerá de nuevo —como era antes de los IPT— sobre el propio SNS, es decir, sobre las propias CCAA que tienen las competencias de su gestión y que necesitan avanzar en la toma de decisiones de posicionamiento multidisciplinar y consensuado, aunque sea a nivel de recomendación. Los servicios de farmacia tendrán que recuperar de nuevo un papel evaluador relevante, para no dejar el campo expedito a la promoción.
No son buenos tiempos para el conformismo; son tiempos que demandan trabajo y crítica, frente a la resignación de un sistema que se desmantela desde dentro, en sincronía con intereses externos.
No obstante, las graves crisis y derrotas sirven para obligarnos un poco a pensar fuera de la caja, y eso implica una dosis de idealismo, puesto que conectados con el suelo ya estamos. Un sistema sanitario centrado en el paciente debería asumir por sí mismo, de forma independiente, la formación continua de sus profesionales, así como la información y la investigación sobre medicamentos. La industria lo ha asumido en exclusiva porque le es rentable; mucho más rentable le sería al sistema sanitario público fomentar una sana independencia a todos sus niveles, y no abocar a los sanitarios a acudir a intereses espurios para progresar científicamente. Esto sí que sería una buena inversión.
Bibliografía
[1] Ministerio de Sanidad. (2025, 8 de abril).
Anteproyecto de Ley de los Medicamentos y
Productos Sanitarios. Consejo de Ministros.
Disponible en: https://
www.lamoncloa.gob.es/consejodeministros/
referencias/paginas/2025/250408-
referencia-rueda-de-prensa-ministros.aspx
[acceso 2/6/2025].
2 Eurodeputada alerta Comissão Europeia
sobre proibição do Avastin em Portugal.
Público 26/4/2010. Disponible en: https://
www.publico.pt/2010/04/26/sociedade/
noticia/eurodeputada-alerta-comissaoeuropeia-
sobre-proibicao-do-avastin-emportugal-
1433980?utm_source=chatgpt.com
[acceso 29/5/2025].
3 Ángel M. Martín Fernández-Gallardo. La
red oscura que las multinacionales
farmacéuticas ocultan tras los pagos a
profesionales sanitarios: sus líderes de
opinión en el SNS y su red de intereses al
descubierto. Revista AAJM, 6/6/2024.
Disponible en: https://
accesojustomedicamento.org/la-red-oscuraque-
las-multinacionales-farmaceuticasocultan-
tras-los-pagos-a-profesionalessanitarios-
sus-lideres-de-opinion-en-el-sns-ysu-
red-de-intereses-al-descubierto/ [acceso
29/5/2025].
4 Martínez-Barros H, Pousada-Fonseca A,
Pedreira-Bouzas J, Clopés-Estela A.
Características, beneficio clínico y
financiación de las nuevas autorizaciones de
fármacos oncohematológicos en España
entre 2017 y 2020. Characteristics, clinical
benefit and reimbursement of new
authorisations for oncohaematology drugs in
Spain between 2017 and 2020. Farm Hosp
2024;48(6):272-7. Disponible en: https://
www.revistafarmaciahospitalaria.es/
index.php?p=revista&tipo=pdfsimple&
pii=S1130634324000795 [acceso
2/6/2025].
5 Cassandra Wyliard. Karolinska Institute
under fire for controversial cancer report.
Revista AJM Nº 39 MAYO 2025 Pág. 23
Emilio Jesús Alegre del Rey
Nature Medicine 2007;13:1124. Disponible
en: https://www.nature.com/articles/
nm1007-1124b [acceso 29/5/2025].
6 Ley 25/1990, de 20 de diciembre, del
Medicamento. Disponible: https://
www.boe.es/buscar/doc.php?id=BOEA-
1990-30938 [acceso 29/5/2025].
7 Utilidad terapéutica de los medicamentos
financiados por el Sistema Nacional de
Salud. INSALUS 2002. Disponible en:
https://ingesa.sanidad.gob.es/dam/
jcr:75c29582-5eaa-4103-
a129-70a0ac05fad7/utilTerap.pdf [acceso
29/5/2025].
8 Lucía Argos. Los medicamentos de 5.000
pesetas cuestan 175 menos a partir de hoy, El
País 26/1/1994. Disponible en: https://
elpais.com/diario/1994/01/26/sociedad/
759538802_850215.html?
utm_source=chatgpt.com [acceso
29/5/2025].
9 El “medicamentazo” ha permitido ahorrar
al Estado 10.000 millones. Última Hora,
4/1/1999. Disponible en: https://
www.ultimahora.es/noticias/sociedad/
1999/01/04/977895/medicamentazopermitido-
ahorrar-estado-000-millones.html
[acceso 29/5/2025]-
10 Cuesta Terán MT, Martínez de la
Gándara M, Martínez Vallejo M. Nuevos
principios activos. Revisión 2002 (2ª parte).
Inf Ter Sist Nac Salud 2003;27(2):57-75.
Disponible en: https://www.sanidad.gob.es/
biblioPublic/publicaciones/docs/
vol27_2nuevospactivosrev022.pdf [acceso
29/5/2025].
11 Catalán A, Recalde JMª, Aizpurúa I, Aza
M, Erviti J. La experiencia del Comité mixto
de Evaluación de Nuevos Medicamentos
(CMENM). Farm At Primaria 2006;7-17.
12 Ortega Eslava A, Puigventós Latorre F,
Santos-Ramos B, Calderón Hernanz B,
Vilanova Boltó M, en representación del
Grupo GENESIS de la SEFH.
Caracterización y variabilidad de los
informes de evaluación de medicamentos en
la página web del grupo GENESIS de la
SEFH. Farm Hosp. 2011;35(3):140-147.
[acceso 29/5/2025].
13 López Briz E, Alegre del Rey EJ, Fraga
Fuentes MªD, Clopés Estela A, Bautista
Paloma J, Ortega Eslava A, en nombre del
Grupo GENESIS de la Sociedad
Española de Farmacia Hospitalaria.
Alternativas terapéuticas equivalentes: en el
ojo del huracán. Farm Hosp.
2013;37(4):273-5.
14 Moon JC, Flett AS, Godman BB, Grosso
AM, Wierzbicki AS. Getting better value
from the NHS drugs budget. BMJ
2011;342:30-2. Disponible en: https://
www.bmj.com/bmj/section-pdf/186177?
path=/bmj/342/7787/Analysis.full.pdf
[acceso 29/5/2025].
15 Soriano Martínez M, Desongles Corrales
T, Gil Navarro MV, Bautista Paloma FJ.
Novedades terapéuticas no recomendadas:
perfil del médico prescriptor. Congreso
SEFH 2009, 207.
16 Puigventós Latorre F, Santos-Ramos B,
Ortega Eslava A, Durán-García ME, en
representación del Grupo de Evaluación de
Novedades, Estandarización e Investigación
en Selección de Medicamentos (GENESIS)
de la Sociedad Espanola de Farmacia
Hospitalaria (SEFH). Variabilidad en la
actividad y los resultados de la evaluación de
nuevos medicamentos por las comisiones de
Pág. 24 R evista AJM Nº 39 MAYO 2025
De la evidencia a la apariencia: cuando la Ley es la trampa
farmacia y terapéutica de los hospitales en
España. Farm Hosp 2011;35(6):305-14.
17 Real Decreto-ley 16/2012, de 20 de abril,
de medidas urgentes para garantizar la
sostenibilidad del Sistema Nacional de Salud
y mejorar la calidad y seguridad de sus
prestaciones. BOE nº 98, 24 de abril de
- Disponible en: https://www.boe.es/
eli/es/rdl/2012/04/20/16 [acceso
2/6/2025].
18 Agencia Española de Medicamentos y
Productos Sanitarios. Informe de
Posicionamiento Terapéutico de Decitabina
(Dacogen®). PT-DECITABINA/
V1/22072014. Publicado el 7 de agosto de - Disponible en: https://
www.aemps.gob.es/
medicamentosUsoHumano/
informesPublicos/docs/IPT-decitabina-
GCPT.pdf [acceso 2/6/2025].
19 Alegre-del Rey EJ, Fénix-Caballero S,
Fraga Fuentes MD, Cárdenas Aranzana MJ,
Lopez-Briz E, Puigventós Latorre F,
Domínguez-Santana CM. La importancia
del posicionamiento terapéutico en la
evaluación post-regulatoria de nuevos
medicamentos. Farm Hosp
2025;49(2):T109-T116. Disponibleen:
https://www.revistafarmaciahospitalaria.es/
es-la-importancia-del-posicionamientoterapeutico-
articulo-S1130634324000977
[acceso 2/6/2025].
20 Agencia Española de Medicamentos y
Productos Sanitarios. Informe de
Posicionamiento Terapéutico de reslizumab
(Cinqaero®) como tratamiento adicional en
el asma eosinofílica grave no controlada.
IPT, 2/2018. Versión 1. Publicado el 9 de
enero de 2018. Disponible en: https://
www.aemps.gob.es/
medicamentosUsoHumano/
informesPublicos/docs/IPT-reslizumab-
Cinqaero.pdf [acceso 2/6/2025].
21 Agencia Española de Medicamentos y
Productos Sanitarios. Informe de
Posicionamiento Terapéutico de atalureno
(Translarna®) en el tratamiento de la
distrofia muscular de Duchenne. IPT,
10/2017. Versión 2. Publicado el 4 de mayo
de 2017; corrección de errores el 8 de junio
de 2017. Disponible en: https://
www.aemps.gob.es/
medicamentosUsoHumano/
informesPublicos/docs/IPT-ataluren-
Translarna-distrofia-muscular-Duchenne.pdf
[acceso 2/6/2025].
22 Agencia Española de Medicamentos y
Productos Sanitarios. Informe de
Posicionamiento Terapéutico de ixazomib
(Ninlaro®) en mieloma múltiple. IPT,
54/2018. Versión 1. Publicado el 5 de
noviembre de 2018. Disponible en: https://
www.aemps.gob.es/
medicamentosUsoHumano/
informesPublicos/docs/IPT-ixazomib-
Ninlaro-mieloma-multiple.pdf [acceso
2/6/2025].
23 Ministerio de Sanidad, Consumo y
Bienestar Social (2020). Plan de acción para
la consolidación de los Informes de
Posicionamiento Terapéutico (IPT).
Disponible en: https://www.sanidad.gob.es/
areas/farmacia/infoMedicamentos/IPT/
docs/
20200708.Plan_de_accion_para_la_consolid
acion_de_los_IPT.actCPF8Julio.pdf [acceso
2/6/2025].
24 Ministerio de Sanidad, Consumo y
Bienestar Social. (2023). Propuesta de
reforma del procedimiento de evaluación de
Emilio Jesús Alegre del Rey
Revista AJM Nº 39 MAYO 2025 Pág. 25
medicamentos en España. Comité Asesor
para la Financiación de la Prestación
Farmacéutica del SNS (21 de marzo de
2023). Disponible en: https://
www.sanidad.gob.es/areas/farmacia/
comitesAdscritos/prestacionFarmaceutica/
docs/
CAPF_Reforma_Expres_Proced_EEE_y_AIP
.pdf [acceso 2/6/2025].
25 Diariofarma. (2023, 26 de julio). La
sentencia de la AN sobre los IPT no afecta al
modelo que Sanidad quería implantar con el
RD de Evaluación. Disponible en: https://
diariofarma.com/2023/07/26/la-sentenciade-
la-an-sobre-los-ipt-no-afecta-al-modeloque-
sanidad-queria-implantar-con-el-rd-deevaluacion
[acceso 2/6/2025].
26 Alegre del Rey EJ. Evaluación y
posicionamiento para la incorporación de
nuevos fármacos en terapéutica: la valiosa
experiencia de REvalMed en España. Rev.
OFIL·ILAPHAR 2023;33(4), 328-31.
Disponible en: https://www.ilaphar.org/wpcontent/
uploads/2023/12/PaginasdesdeILAPHAR-
vol-33-n-4.pdf [acceso
2/6/2025].
27 Ministerio de Sanidad. (2024, 12 de
agosto). Proyecto de Real Decreto por el que
se regula la evaluación de tecnologías
sanitarias. Disponible en: https://
www.sanidad.gob.es/normativa/audiencia/
docs/
DG_54_24_Solicitud_informacion_publica_
RD_EVALUACION_TECNOLOGIAS_SA
NITARIAS.pdf [acceso 2/6/2025].
[28] Puigventós F, Alegre del Rey EJ. La
cuarta garantía en la evaluación de
medicamentos. Revista de la Asociación
Acceso Justo al Medicamento 2024 (27):1-4.
Disponible en: https://
accesojustomedicamento.org/la-cuartagarantia-
en-la-evaluacion-demedicamentos/
[acceso 2/6/2025].
[29] Parlamento Europeo y Consejo. (2021,
22 de diciembre). Reglamento (UE)
2021/2282 sobre evaluación de las
tecnologías sanitarias y por el que se
modifica la Directiva 2011/24/UE. Diario
Oficial de la Unión Europea, L 458, 1–32.
Disponible en: https://www.boe.es/doue/
2021/458/L00001-00032.pdf [acceso
2/6/2025].
[30] Redacción Médica. (2020, 23 de julio).
Formación médica sin financiación de la
industria: «Es un brindis al sol». https://
www.redaccionmedica.com/secciones/
sanidad-hoy/formacion-medica-sinfinanciacion-
de-la-industria-es-un-brindis-alsol–
9309 [acceso 2/6/2025].
[31] Comité Asesor para la Prestación
Farmacéutica. (2022, 15 de junio).
Recomendaciones finales sobre los criterios y
procedimiento para orientar la fijación de
precios y la inclusión y exclusión, a la
entrada en el mercado o con posterioridad,
de un medicamento en la cobertura pública.
Ministerio de Sanidad. Disponible en:
https://www.sanidad.gob.es/areas/
farmacia/comitesAdscritos/
prestacionFarmaceutica/docs/
20220615_Recoms_Finales_LE2_1LE2_2_
CAPF_v15.pdf [acceso 2/6/2025].
[32 Comité Asesor para la Financiación de la
Prestación Farmacéutica (CAPF). (2024, 27
de febrero). Guía de Evaluación Económica
de Medicamentos. Ministerio de Sanidad.
Disponible en: https://www.sanidad.gob.es/
areas/farmacia/comitesAdscritos/
prestacionFarmaceutica/docs/
20240227_CAPF_Guia_EE_definitiva.pdf
[acceso 2/6/2025].
[33] Comité Asesor para la Financiación de la
Prestación Farmacéutica (CAPF). (2021, 25
de noviembre). Recomendaciones sobre los
Informes de Posicionamiento Terapéutico
(IPT) de los medicamentos en el Sistema
Nacional de Salud. Ministerio de Sanidad.
Disponible en: https://www.sanidad.gob.es/
areas/farmacia/comitesAdscritos/
