OTRAS FUENTES. Revista nº 36, febrero 2025
Jeanne Lenzer – Shannon Brownlee.
Jacobin Review, 02-01-2025, https://jacobin.com/2025/02/alzheimers-drugs-approval-regulations-death
Hemos creído necesario continuar con el tema de los medicamentos para la enfermedad de Alzheimer, pues es indudablemente un tema que refleja muy bien las presiones de la industria farmacéutica sobre la prescripción clínica de los profesionales.
En la revista de noviembre-diciembre incluimos un artículo de rigor notable de Felix Bermejo y Victoria Zunzunegui, donde analizaban las serias dudas sobre la aprobación de lecanemab para la enfermedad de Alzheimer por la EMA. Acompañamos este articulo con la publicación de un informe” El legado devastador de las mentiras en la enfermedad de Alzheimer” en el que Charles Piller comentaba de forma demoledora: “la arrogancia y la laxitud ante la mala conducta (que comparten financiadores y reguladores, revistas y universidades) tienen que cambiar”.
Pues bien, a continuación, podemos leer un excelente artículo que completa de forma extraordinaria la visión sobre el Alzheimer y los nuevos medicamentos, que la industria farmacéutica impone, pues a las serias dudas sobre su efectividad clínica y los riesgos que conllevan, junto con los altos costes que suponen para pacientes y sistemas sanitarios.
Un texto largo, pero absolutamente recomendable.
La Administración de Alimentos y Medicamentos ha aprobado controvertidos tratamientos farmacológicos para la enfermedad de Alzheimer en medio de un exceso de muertes, eficacia cuestionable y conflictos de intereses entre los reguladores, los defensores de los pacientes y las grandes farmacéuticas.
Hace seis años, Genevieve Lane disfrutaba de una vida activa en Florida cuando empezó a olvidar los nombres de sus vecinos y dónde dejaba las llaves. A sus setenta y seis años, podría haber restado importancia a estos lapsus como simples signos del envejecimiento, pero cuando empezó a tener momentos de confusión y a perderse ocasionalmente mientras caminaba, su compañera de casa y amiga de toda la vida, Vicki Holmes, le habló de un centro de investigación cercano. Allí, un médico le diagnosticó Alzheimer en etapa temprana y le habló de un estudio que probaba un nuevo fármaco prometedor. Lane se inscribió y le dijo a su hija que quería disponer de más tiempo.
Poco después de que comenzara a recibir las infusiones dos veces al mes, ella y Holmes creyeron que su memoria estaba mejorando. “Al principio, realmente pensamos que estaba funcionando”, dijo Holmes. Pero Lane no estaba tomando el fármaco; estaba recibiendo el placebo, infusiones de solución salina. Cuando el ensayo concluyó después de dieciocho meses, comenzó a recibir el fármaco real, de marca Leqembi, como parte de la fase de extensión del estudio.
Seis semanas después, Lane estaba muerta.
La familia de Lane pidió una autopsia. “Pensé que el medicamento la había matado”, nos dijo Yvonne Battaglia, su hija. “No confiaba en el medicamento ni en la compañía farmacéutica”. Pero tanto la firma de investigación contratada por la farmacéutica como el hospital donde murió dijeron que no podían realizar una autopsia. Así que Battaglia y su familia contrataron a un neuropatólogo independiente.
El patólogo encontró que el cerebro de Lane estaba plagado de vasos sanguíneos rotos, inflamación generalizada y áreas de células muertas. Una segunda autopsia, realizada en el Centro Médico de la Universidad de Vanderbilt, donde la familia donó su cerebro, confirmó la causa de la muerte: inflamación cerebral grave, probablemente debida a Leqembi.
Ella no fue la única paciente que sufrió daños mientras tomaba el medicamento. Aunque la compañía que fabrica Leqembi no informó de ninguna muerte relacionada con el medicamento durante su estudio de dieciocho meses, se produjeron cuatro muertes relacionadas con el medicamento más tarde, durante la fase de extensión del estudio, en la que participaron 714 pacientes que tomaban el medicamento. Y la muerte no fue el único resultado catastrófico. Durante el ensayo principal, al menos dos pacientes que al principio presentaban problemas leves de memoria quedaron discapacitados después de recibir el medicamento, incapaces de cuidar de sí mismos o de reconocer a sus familias. El 22 por ciento de los pacientes que tomaron Leqembi sufrieron hemorragia o inflamación cerebral, más del doble del 10 por ciento de los que tomaron placebo.
Sin embargo, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA), que regula los productos médicos, aprobó el fármaco en 2023.
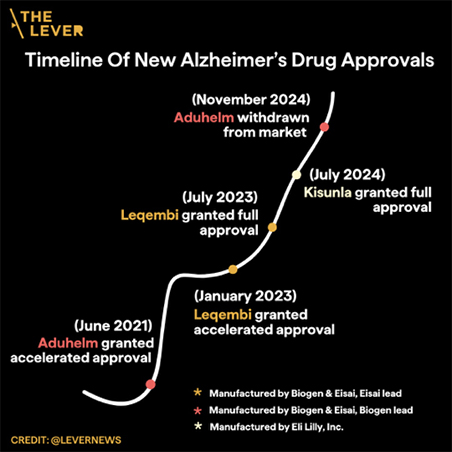
Leqembi es uno de los tres medicamentos contra el Alzheimer de la misma clase, todos ellos presentados con una extraña mezcla de escepticismo y fanfarria en los últimos cuatro años. El predecesor de Leqembi, Aduhelm, lanzado en 2021, ya está fuera del mercado tras las acusaciones en un acuerdo secreto entre los fabricantes del medicamento y los reguladores (los fabricantes citaron razones comerciales para retirar el fármaco). El tercer fármaco de la clase, Kisunla, fue aprobado en julio de 2024. En los estudios de Kisunla, los pacientes experimentaron lesiones cerebrales asociadas al fármaco en una tasa más alta que con Leqembi. Sin embargo, algunos médicos, ejecutivos farmacéuticos y periodistas están aclamando ambos fármacos como medicamentos «revolucionarios», los primeros fármacos que podrían «cambiar el curso» de la enfermedad de Alzheimer.
¿Pero son realmente avances?
Pocas enfermedades son tan perniciosas como el Alzheimer, que puede ir devorando lentamente a la persona por completo. Si la evolución de la enfermedad pudiera modificarse significativamente con medicamentos, algunos pacientes estarían sin duda dispuestos a asumir algún riesgo, y la aprobación de un fármaco eficaz daría a los pacientes y a sus familias más opciones para el tratamiento de la enfermedad. Los fabricantes de Leqembi y Kisunla sostienen que los estudios de sus fármacos, y la posterior aprobación de los mismos por parte de la FDA, confirman que los beneficios potenciales de los tratamientos superan a los riesgos.
Pero esta investigación ha descubierto pruebas de que tanto los fabricantes de fármacos como la FDA han restado importancia a los posibles daños y han exagerado los beneficios potenciales. The Lever descubrió datos relacionados con la aprobación de Kisunla; cuando el fármaco se presentó por primera vez para su revisión, la agencia rechazó su aprobación, señalando un “desequilibrio en las muertes”, así como falta de datos porque la empresa había perdido el rastro de casi una cuarta parte de los pacientes que participaron en un estudio clave. La FDA le dijo a la empresa que tendría que averiguar si estaban vivos o muertos.
The Lever también descubrió que tres de los cuatro asesores médicos de la FDA que votaron a favor de Leqembi tenían vínculos financieros con los fabricantes u otras compañías farmacéuticas. Además, los datos de los ensayos clínicos muestran que los efectos de los medicamentos sobre la función cognitiva pueden ser menores de lo que los pacientes y sus cuidadores suelen ser capaces de percibir. Cuando comenzaron a surgir los malos resultados de los estudios, un panel convocado por una influyente organización de pacientes vinculada a las compañías farmacéuticas sugirió un parámetro más bajo para medir la eficacia de los medicamentos.
La administración Trump está enviando mensajes contradictorios sobre su plan de reforma de la FDA y el proceso de aprobación de medicamentos. El candidato del presidente para secretario del Departamento de Salud y Servicios Humanos, Robert F. Kennedy Jr, quiere facilitar que los tratamientos cuestionables lleguen al mercado, afirmando que la FDA está librando una “guerra contra la salud pública” al bloquear la aprobación de terapias no probadas como la hidroxicloroquina para prevenir la COVID-19. Kennedy también ha promovido una regulación más estricta de las vacunas.
El 3 de enero, la FDA escribió en un correo electrónico que estaba trabajando en una respuesta a una consulta de Lever ante las críticas que consideran que los efectos de los nuevos medicamentos contra el Alzheimer son demasiado pequeños para ser percibidos por los pacientes y los cuidadores y que los medicamentos plantean “serias preocupaciones de seguridad”. Sin embargo, el 23 de enero, la agencia nos envió un correo electrónico indicando que el Departamento de Salud y Servicios Humanos “ha emitido una pausa en las comunicaciones masivas… que no estén directamente relacionadas con emergencias o sean críticas para preservar la salud”.
La empresa farmacéutica japonesa Eisai, que desarrolló Leqembi en asociación con la empresa biotecnológica estadounidense Biogen, dijo a The Lever que sus estudios muestran que el fármaco es seguro y eficaz. La empresa citó la votación unánime de los asesores de la FDA para aprobar Leqembi como confirmación del “beneficio clínico” del fármaco y su “perfil general de beneficio-riesgo”. Eli Lilly, el fabricante de Kisunla, afirmó que su estudio mostró que la desaceleración de la demencia se logró “de manera muy confiable”. La FDA también mantiene que los nuevos fármacos son “seguros y eficaces”, como se describe en sus documentos de revisión.
A pesar de las garantías de la agencia y los fabricantes, muchos neurólogos siguen dudando recetar los nuevos fármacos. Madhav Thambisetty, ex investigador principal del Instituto Nacional sobre el Envejecimiento de los Institutos Nacionales de Salud (ahora es director ejecutivo de medicina traslacional de neurociencia en la compañía farmacéutica Novartis), nos dijo que pensaba que Leqembi podría ofrecer un beneficio modesto, pero que sólo lo recetaría después de advertir a sus pacientes sobre lo que se sabe (y lo que no) acerca de los efectos secundarios potencialmente graves. Cuando se le preguntó si recomendaría el medicamento si sus propios familiares quechua desarrollaran Alzheimer, su respuesta fue escueta: «Absolutamente no».
Reshma Ramachandran, codirectora de la Colaboración de Yale para el Rigor, la Integridad y la Transparencia Regulatoria y experta en el análisis de ensayos clínicos, nos comentó que Leqembi y Kisunla «plantean graves riesgos de seguridad y, en el mejor de los casos, un beneficio poco claro» y «están dando falsas esperanzas a los pacientes y a sus médicos». Rudolph Castellani, profesor de neuropatología en la Universidad Northwestern, nos dijo que le preocupa que si los medicamentos se recetan ampliamente, sus efectos tóxicos podrían convertirse en «un desastre de salud pública».
Los medicamentos deben administrarse por vía intravenosa en lugar de tomarse en forma de píldora, y eso ha limitado hasta ahora el mercado. En una conferencia telefónica sobre los resultados de noviembre de 2024, Eisai informó que aproximadamente cuatro mil pacientes habían tomado Leqembi y que los hospitales están estableciendo centros de infusión para ofrecer el tratamiento de manera más amplia. (La empresa se negó a publicar datos más recientes).
Un dato clave que los médicos y los pacientes necesitan para evaluar si vale la pena tomar los medicamentos es la tasa de eventos adversos graves que causan. Los eventos adversos graves se definen como discapacidad permanente, necesidad de hospitalización o muerte. Según los fabricantes de medicamentos, los pacientes que tomaron Leqembi o Kisunla sufrieron eventos adversos graves durante los ensayos clínicos en tasas más altas que los que tomaron un placebo.
Se estima que entre cinco y siete millones de personas padecen deterioro cognitivo leve debido a la enfermedad de Alzheimer, pero sólo 1,28 millones han sido diagnosticadas de la enfermedad. Incluso si sólo aquellos que han sido diagnosticados tomaran finalmente uno de los medicamentos, los datos descubiertos por Lever sugieren que decenas de miles de pacientes podrían quedar gravemente lesionados , discapacitados o muertos.
Durante el ensayo clave de Leqembi, cinco pacientes sufrieron grandes hemorragias cerebrales (conocidas como «macrohemorragias») en comparación con sólo un paciente que tomó el placebo. «Incluso si la tasa de mortalidad no resulta ser mayor, el aumento de las grandes hemorragias cerebrales es preocupante», sfirmó Steven Goodman, médico y profesor de epidemiología en la Universidad de Stanford y experto en diseño de ensayos clínicos. «Algunos de los efectos secundarios de los medicamentos son tan graves como los síntomas de Alzheimer que los pacientes están tratando de evitar».
Los fabricantes de medicamentos ahora apuntan a mercados aún más grandes al ampliar el tratamiento a personas con síndrome de Down y a aquellos que no tienen problemas de memoria en absoluto pero podrían estar en riesgo de desarrollar Alzheimer. El precio de lista de Leqembi es de 26.500 dólares al año, y el de Kisunla, de 32.000. Si a eso añadimos el coste no sólo de los medicamentos, sino también el precio de los análisis de sangre necesarios, las punciones lumbares y las exploraciones de diagnóstico por imágenes, se calcula que el precio total por paciente en Estados Unidos para Leqembi asciende a 109.000 dólares por paciente al año.
Castillo de naipes
El camino hacia los nuevos medicamentos para el Alzheimer se estableció hace más de treinta años con el desarrollo de una teoría que plantea que la enfermedad es causada principalmente por la acumulación de una proteína en el cerebro llamada beta amiloide. Aunque los depósitos amiloides están presentes en el cerebro de los pacientes de Alzheimer, algunas personas con amiloide nunca se vuelven dementes, y nadie ha demostrado definitivamente que la proteína cause la enfermedad en lugar de ser un subproducto de la misma.
Los expertos han hecho agujeros en la llamada «hipótesis amiloide» durante años. Recientemente, las dudas sobre la teoría aumentaron cuando una investigación en curso, publicada en la revista Science en 2022, encontró que las imágenes técnicas utilizadas en un estudio clave que prestaban apoyo a la hipótesis habían sido manipuladas.
Con poco más por decir, la industria farmacéutica ha Invertido miles de millones de dólares en las últimas dos décadas en la investigación y el desarrollo de medicamentos antiamiloides. Desde 2004 hasta 2021, las empresas persiguieron al menos veintitrés de ellos, todos los cuales resultaron inútiles o incluso peligrosos. En algunos estudios, la cognición de los pacientes empeoró; en otros, sufrieron efectos secundarios graves, incluyendo convulsiones implacables, encefalitis y muerte
La llegada de Aduhelm, Leqembi y Kisunla.
Estos medicamentos emplean anticuerpos monoclonales para atacar el amiloide, al igual que la manera en que el sistema inmunológico ataca a un virus. Los tres han demostrado ser altamente efectivos para eliminar el amiloide del cerebro. Desafortunadamente, poco más sobre ellos es tan sencillo.
El primero de la clase, Aduhelm, fue codesarrollado por Biogen y Eisai. Biogen detuvo sus dos estudios fundamentales de Aduhelm temprano, citando «futilidad». En otras palabras, la droga no funcionó. Más tarde, la compañía volvió a analizar los mismos datos, esta vez produciendo resultados contradictorios: un estudio mostró una ligera desaceleración de la demencia; otro, que era casi idéntico en diseño, era negativo y el medicamento no confirmó ningún beneficio para los pacientes.
En las casi mil páginas de análisis de la FDA sobre Aduhelm se encontraron algunos hallazgos preocupantes. Cuando los revisores de la FDA compararon la cantidad de reducción de amiloide en los pacientes que tomaban los medicamentos con su función cognitiva, no hubo correlación. En otras palabras, los pacientes podrían experimentar una reducción significativa de amiloide sin desaceleración de la pérdida de memoria.
Después de que Biogen presentó sus datos a la FDA, la agencia convocó una reunión del comité asesor de expertos externos en 2020. (Estas reuniones se llevan a cabo cuando los resultados de los estudios son contradictorios o inciertos). Los funcionarios de la FDA le dijeron al panel de revisión externo que el estudio de resultado negativo no era confiable y les pidieron que se concentraran en el estudio positivo, que mostraba cierta desaceleración de la demencia. Billy Dunn, el principal funcionario de neurociencia de la agencia, también les informó que la agencia no consideraría la eliminación de amiloide como base para la aprobación, afirmando : «No estamos usando amiloide como sustituto de la eficacia». En cambio, la FDA quería que los asesores evaluaran el efecto del medicamento en la desaceleración de la demencia.
Los miembros del comité protestaron porque los estudios eran casi idénticos en diseño y era irracional centrarse solo en el estudio positivo. Le dieron al medicamento un voto en contra rotundo (diez personas del comité de once personas consideraron que no había suficientes pruebas de la eficacia del medicamento; el undécimo confirmó que no estaba seguro).
Por sugerencia de Dunn, Biogen solicitó la aprobación acelerada de Aduhelm basándose en su capacidad para eliminar amiloide en lugar de si realmente se había demostrado que ralentizaba la demencia.
Este era precisamente el enfoque que Dunn había dicho a los asesores que la FDA no utilizaría. Entonces, cuando la agencia anunció a principios de 2021 que anulaba a sus asesores y otorgaba la aprobación basándose en las reducciones de amiloide, tres de los asesores renunciaron en protesta. Uno de ellos, Aaron Kesselheim, profesor de medicina en Harvard y un destacado experto en el proceso de aprobación de medicamentos de la FDA, lo calificó como «probablemente la peor decisión de aprobación de medicamentos en la historia reciente de EE. UU.»
El resultado fue un desastre de comunicaciones públicas de la FDA sobrev el fármaco. La prensa detectó una serie de desviaciones del protocolo de la agencia, incluido un plan que Biogen denominó Proyecto Onyx en el que sus científicos y los gerentes de la FDA, incluido Dunn, trabajaron juntos para lograr la aprobación del fármaco. Una investigación del Congreso concluyó que Dunn tenía una relación inapropiada con Biogen y que la aprobación estaba «plagada de irregularidades». Algunos hospitales destacados se negaron a proporcionar Aduhelm a los pacientes y, a principios de 2024, Biogen anunció que dejaría de fabricar el fármaco.
Cuando el siguiente fármaco de la clase, Leqembi, se sometió a revisión en 2022, se parecía a Aduhelm en muchos aspectos. Ambos fármacos fueron desarrollados por Biogen y Eisai (con Eisai asumiendo el papel principal en el caso de Leqembi). Al igual que Aduhelm, el primer ensayo clínico de Leqembi no logró confirmar que los pacientes que tomaron el fármaco tuvieran mejores resultados que los que tomaron placebo, según la prueba cognitiva principal de la empresa. Eisai utilizó los efectos secundarios, incluida la eliminación de amiloide, para solicitar la aprobación acelerada, y la FDA aprobó el medicamento en enero de 2023, basándose en los resultados en solo 152 pacientes.
Al mismo tiempo, hubo evidencia de que el medicamento causó daños graves. La FDA detectó complicaciones asociadas con Leqembi, complicaciones que la empresa minimizó o no había incluido en su resumen de «eventos adversos». La FDA señaló que Eisai no había informado de los síntomas causados por la inflamación cerebral en dos pacientes (uno tuvo una convulsión) y omitió dos casos de hemorragia cerebral.
Conflictos de intereses
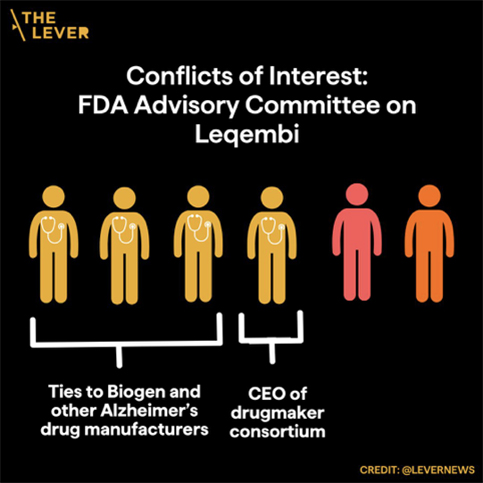
Antes de que se revisara un segundo estudio más amplio de Leqembi, la FDA reemplazó a su comité asesor de once miembros, que estaba compuesto principalmente por médicos académicos independientes que habían rechazado Aduhelm. El nuevo comité asesor de seis miembros incluía a cuatro médicos, un bioestadístico y un representante de los pacientes.
Según nuestro análisis, tres de los cuatro asesores médicos tenían conflictos de intereses financieros con Biogen, el socio de Eisai en el desarrollo de Leqembi, que incluían honorarios por consultoría, conferencias y financiación de investigación de la empresa. Un cuarto asesor era el director ejecutivo de un consorcio de desarrollo de fármacos cuyos miembros incluían a Eisai, Biogen y Eli Lilly. El consorcio recibe financiación de las empresas farmacéuticas y afirma que uno de sus éxitos fue haber «impulsado un progreso crucial» para la aprobación de Aduhelm y Leqembi.
Las normas de la FDA exigen que los asesores sean lo más independientes posible de las compañías farmacéuticas. Si bien sus vínculos financieros no necesariamente sugieren una mala conducta, los estudios han demostrado que los investigadores y los médicos con tales conexiones en la industria tienen más probabilidades de ver los medicamentos de manera favorable que los expertos sin conflictos de intereses.
Desde que el panel asesor recientemente constituido dio el visto bueno unánime a Leqembi, no hubo espectáculo de denuncias públicas por su aprobación por parte de la FDA, y el medicamento no fue objeto de la misma diatriba en la prensa que Aduhelm. De hecho, la cobertura fue de celebración. La revista Time ungió al medicamento como uno de los «mejores inventos de 2023».
En una conferencia de prensa el 7 de marzo de 2024, Eisai anunció un plan coordinado para impulsar las ventas de Leqembi, incluido el lanzamiento planificado de un nuevo análisis de sangre para la enfermedad de Alzheimer que identificaría rápidamente a más pacientes. El análisis de sangre, junto con el desarrollo de una versión inyectable del medicamento que los pacientes pueden usar en casa, podría ayudar a trasladar el tratamiento a manos de los proveedores de atención primaria.
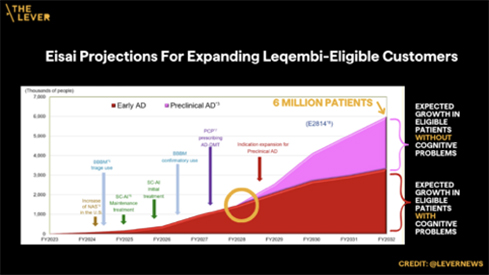
Pero el mayor aumento de las ventas podría provenir de los resultados de un ensayo clínico en el que se prueba Leqembi en personas que no tienen problemas de memoria pero que podrían estar en riesgo de desarrollar la enfermedad porque tienen una predisposición genética o signos de depósitos de amiloide en el cerebro. En la conferencia de prensa, la empresa estimó que su mercado potencial se duplicaría aproximadamente hasta alcanzar los seis millones de clientes potenciales para 2032 si la FDA aprueba Leqembi para este uso «preclínico».
Pero los riesgos y efectos de Leqembi (junto con Kisunla, que también fue ampliamente elogiado cuando salió el verano pasado) son muy similares a los de Aduhelm, que ya no está en el mercado.
“Todos los nuevos medicamentos para el Alzheimer (Aduhelm, Leqembi y Kisunla) son esencialmente iguales”, dijo a The Lever, George Perry, profesor de neurociencia en la Universidad de Texas en San Antonio y editor en jefe del Journal of Alzheimer’s Disease. “Funcionan mediante el mismo mecanismo y demuestran la misma eficacia insignificante y los mismos daños graves”.
“Tóxico y potencialmente letal”
En 2019, una mujer de sesenta y tantos años llamada Monique vivía con su esposo Richard en las afueras de París cuando las preocupaciones por la pérdida de memoria la llevaron a ver a un neurólogo. (Richard pidió que usáramos solo sus nombres de pila). Ella y el neurólogo hablaron sobre un ensayo clínico de Leqembi y se inscribió. Después de la undécima infusión del fármaco, Monique fue llevada al hospital mientras sufría una serie de convulsiones que pusieron en peligro su vida, que su neurólogo determinó que eran causadas por una inflamación cerebral relacionada con Leqembi.
Una cascada de nuevos problemas siguió a las convulsiones, lo que mantuvo a Monique en el hospital durante meses. Cuando su familia pudo verla, recuerda Richard, «estaba delirando, alucinando, tirando de los equipos médicos, con las extremidades atadas a las barandillas de la cama, sufriendo, sin reconocernos». Una vez en casa, Monique cayó rápidamente en la demencia. Los pocos momentos en que ahora está lúcida son difíciles de una manera diferente, dijo Richard, porque vislumbra la realidad de su condición.
Cinco meses después del ingreso de Monique en el hospital, otra parisina, Nicole Nicolle, de setenta años, estaba en la sala de emergencias, habiendo perdido la mitad de la visión en cada ojo. Una tomografía computarizada mostró una hemorragia cerebral masiva. Ella también estaba en el estudio Leqembi y estaba recibiendo el fármaco. En un plazo de dieciocho meses, había pasado de un deterioro cognitivo leve a una demencia avanzada, un proceso que normalmente puede llevar hasta una década. Hoy, su hija Céline Marzin dice que su madre rara vez reconoce a la familia. “Está en su propio mundo”, nos dijo Marzin. “Nadie puede entrar”.
Tanto la hinchazón como el sangrado del tipo que experimentaron Monique y Nicolle son el resultado de que las drogas hacen su trabajo, dice Castellani de Northwestern. El exceso de amiloide en el cerebro a menudo vive en las paredes de los vasos sanguíneos, y cuando se elimina, «puede ser como arrancar una costra de una herida», dijo. Los vasos sanguíneos se trituran y se inflaman y gotean, lo que causa hinchazón y hemorragia cerebral. En casos graves, los vasos sanguíneos dañados comienzan a morir. Como afirma Castellani, «La conclusión es que estás lidiando con una droga tóxica y potencialmente letal».
Muchos pacientes que están tomando el medicamento sufren hemorragias cerebrales más pequeñas y menos hinchazón que Monique y Nicolle. Los fabricantes afirman que estas generalmente se «resuelven» o disminuyen por sí solas . Algunos no causan síntomas. Pero nadie conoce las consecuencias a largo plazo de estos incidentes, ya que, por ejemplo, puedan acelerar la progresión de la demencia, especialmente cuando ocurren repetidamente. Para estar seguros, los expertos consideran que los investigadores que no están siendo pagados por las empresas necesitan información sobre pacientes que han experimentado hemorragias cerebrales e inflamación .
Mientras Thambisetty todavía estaba en el Instituto Nacional sobre el Envejecimiento, él y otros investigadores solicitaron a Eisai que publicara información sobre estas complicaciones, sin obtener nada. La compañía respondió que no proporcionaría datos de pacientes mientras el medicamento esté bajo revisión regulatoria global. Pero es ahi «exactamente cuando se necesitan los datos», comenta Perry del Journal of Alzheimer’s Disease. Sin esta información , los reguladores no pueden revisar los análisis de fuentes independientes.
Incluso con respecto a la prevalencia del efecto secundario potencial más grave de Leqembi, la muerte, hay incertidumbres. En diciembre de 2022, Eisai publicó los resultados de su ensayo clínico clave de Leqembi en New England Journal of Medicine, en el que los autores declararon: «Los investigadores consideraron que ninguna muerte estuviera relacionada» con el medicamento. Agregaron: «Los ensayos más largos están justificados para determinar la eficacia y seguridad de [Leqembi] en la enfermedad de Alzheimer temprana».
Sin embargo, una investigación más exhaustiva de las complicaciones del fármaco no parecía ser una prioridad para Eisai; la empresa no informó de ninguna autopsia de los seis pacientes que murieron durante la fase principal del estudio mientras tomaban el fármaco, del total de los 898 participantes que lo tomaban . Saltarse la autopsia es habitual cuando la causa de la muerte parece claramente no estar relacionada con el fármaco en cuestión, pero es potencialmente muy importante cuando un fármaco puede dañar repentinamente el cerebro y cuando la muerte podría atribuirse incorrectamente a algo distinto del fármaco.
Según Bryce Vissel, director del programa de neurociencia y medicina regenerativa del Hospital St Vincent de Sídney, «sin una autopsia, no hay forma de excluir la posibilidad de que el fármaco contribuyera o incluso causara sus muertes». (Eisai no pregunta rutinariamente a las familias si les gustaría que se les haga una autopsia cuando un paciente muere, pero dice que solicita copias de cualquier informe de autopsia realizado por patólogos independientes).
Poco después de que se completara la fase principal del ensayo, surgieron los resultados de la autopsia de dos pacientes que murieron mientras tomaban Leqembi durante la fase de extensión del estudio. Ambos implicaron al medicamento.
Uno de los pacientes era Genevieve Lane, la paciente de Florida que murió seis semanas después de comenzar las infusiones del medicamento. Su autopsia fue realizada por un equipo de médicos de la Universidad de Vanderbilt dirigido por el neurólogo Matthew Schrag, profesor adjunto de neurología. Él y once colegas publicaron sus hallazgos en la revista médica Nature Communications, documentando inflamación y hemorragia, efectos conocidos del medicamento. El artículo incluía imágenes y un video de los vasos sanguíneos en el cerebro de Lane.
Schrag envió sus hallazgos a Eisai y solicitó información adicional. Pero la respuesta de la compañía, afirmó, «fue muy lenta» y no llegó a tiempo. Basándose en los documentos que Eisai presentó a la FDA, la agencia declaró que “no se pueden sacar conclusiones firmes” sobre la causa de la muerte de Lane, porque la empresa comunicó a los reguladores que no pudo obtener “documentos críticos que sustenten los hallazgos [del equipo de Schrag]”.
En un correo electrónico a Lever, Eisai calificó las conclusiones de Schrag de la autopsia como una “opinión”. Cuando se le preguntó qué medidas tomó la empresa para confirmar o refutar los hallazgos, un portavoz de Eisai respondió: “Generalmente no interactuamos directamente con investigadores independientes porque no queremos estar en posición de influir o sesgar su opinión”.
Los hallazgos de otra autopsia, realizada a Jean Terrien, una mujer atlética de sesenta y cinco años que murió a fines de 2022, sugirieron que el medicamento jugó un papel en su muerte. Terrien fue trasladada de urgencia a una sala de emergencias de Chicago, confundida e incapaz de hablar. Cuando murió cuatro días después, Castellani, el neuropatólogo de Northwestern, realizó la autopsia. Informó que murió de hemorragia cerebral extensa similar a las de Lane.
Eisai también calificó los hallazgos de la autopsia de Castellani como una “opinión”, sugiere que Terrien murió de un derrame cerebral y una hemorragia cerebral causada por un fármaco trombolítico utilizado para tratar un presunto derrame cerebral. Castellani responde : “No tuvo un derrame cerebral típico; tuvo un efecto imitador de un derrame cerebral” causado por los efectos secundarios de Leqembi. Concluye que su muerte fue el resultado de una cascada de eventos desencadenados por el medicamento, y agrega: “Si no le hubieran administrado Leqembi, no habría tenido el efecto similar a una isquemia cerebral que llevó a los médicos a tratarla con un trombolítico”.
En mayo de 2024, Eisai informó que cuatro de las nueve muertes durante la fase de extensión estaban “posiblemente” relacionadas con el medicamento.
Los pacientes también murieron durante los ensayos de Kisunla, el nuevo fármaco contra Alzheimer. Eli Lilly, el fabricante del fármaco, presentó sus datos a la FDA en 2022. La agencia observó un «desequilibrio» en las muertes: diecisiete pacientes (2,7 por ciento) que tomaban Kisunla murieron durante los ensayos clínicos, en comparación con diez (1,4 por ciento) que tomaron un placebo. Además, resultó que Eli Lilly había dejado de hacer el seguimiento de 391 pacientes que abandonaron el ensayo de 1.736 pacientes. Las personas que participan en los ensayos clínicos suelen abandonar cuando sufren efectos secundarios, y algunas pueden morir posteriormente. No incluir a esos pacientes que abandonan en el análisis de los datos puede hacer que un fármaco parezca más seguro y eficaz de lo que es.
La FDA rechazó el primer intento de la empresa de conseguir la aprobación de Kisunla, citando la gran cantidad de datos que faltaban, y dio instrucciones de localizar a los pacientes que faltaban.
Para ello, Eli Lilly recurrió a un proveedor externo anónimo, que investigó a los pacientes que faltaban. El proveedor localizó a la mitad de ellos y reportó dos muertes adicionales entre los participantes que tomaron Kisunla y otras cinco entre los pacientes que tomaron placebo. Los hallazgos redujeron un poco la diferencia en muertes entre los dos grupos (la mortalidad fue del 2,5 por ciento con Kisunla y del 1,9 por ciento con placebo). Sin embargo, varios expertos comentaron a Lever que la falta de transparencia sobre el consultor externo y sus métodos hacían imposible que los investigadores independientes evalúen la confiabilidad de los nuevos datos.
Sin embargo, la FDA aprobó Kisunla el verano pasado sobre la base de su efecto sobre la cognición, con la condición de que Eli Lilly realizara un estudio de seguridad después de que el medicamento estuviera en el mercado. Este tipo de acuerdo no es infrecuente. La agencia se ha mostrado cada vez más dispuesta a permitir que las empresas demuestren la seguridad y eficacia de sus medicamentos después de la aprobación. Aunque la empresa tiene que presentar informes de seguridad semestrales a la FDA, el informe final sobre Kisunla no está previsto hasta febrero de 2037.
Diana Zuckerman, presidenta del Centro Nacional de Investigación en Salud, una organización sin fines de lucro con sede en Washington, DC, nos dijo en un correo electrónico que este plazo es “inaceptable”. Establecer si un medicamento aumenta las muertes y los daños irreparables debería llevar solo unos pocos años, escribió, no trece.
Pero, ¿funcionan?
¿Qué efectos tienen en realidad Leqembi y Kisunla sobre la memoria y la capacidad mental? Los fabricantes de los fármacos no afirman que mejoren estas funciones en los pacientes con Alzheimer, sino que los fármacos ralentizan el ritmo de deterioro. Pero incluso utilizando ese criterio, la evidencia sugiere que los fármacos hacen muy poco.
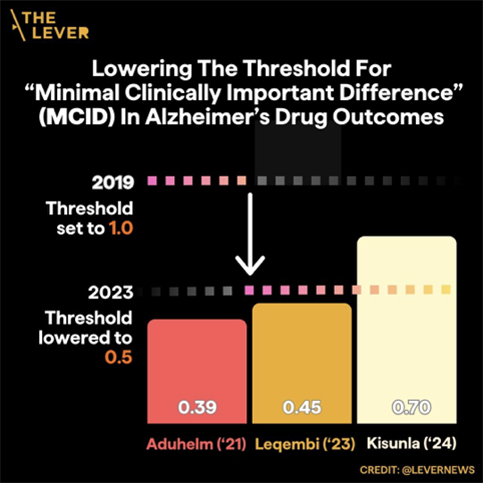
Al evaluar Leqembi durante sus ensayos, Eisai utilizó una prueba ampliamente aceptada llamada CDR-SB (abreviatura de “Clinical Dementia Rating — Sum of Boxes”) para medir los cambios en la función cognitiva de los pacientes. La prueba plantea preguntas como: “¿Recuerda la fecha de su boda?” y “¿Qué tan bien puede realizar tareas diarias como vestirse?” Las puntuaciones de la prueba pueden variar de cero a dieciocho puntos. La diferencia entre los pacientes que recibieron Leqembi y los que recibieron un placebo después de un año y medio de tratamiento fue de 0,45 puntos.
Esta es una diferencia pequeña. En 2019, Eli Lilly publicó un estudio con datos de aproximadamente 35.000 pacientes a los que se les realizó la prueba CDR-SB anualmente durante un año o más. Ese estudio concluyó que, para que los efectos de un fármaco fueran perceptibles para los pacientes y sus cuidadores, las puntuaciones de los pacientes en la prueba CDR-SB tenían que variar al menos en un punto completo para aquellos con deterioro cognitivo leve y en 1,6 puntos para aquellos con Alzheimer en etapa temprana. Desde entonces, estas cifras han sido aceptadas como los estándares no oficiales para la “diferencia mínima clínicamente importante”. Leqembi no logró cumplir con ese estándar. Kisunla, que produjo una diferencia de 0,7 puntos, también fracasó.
Eso no ha impedido que los fabricantes de medicamentos promocionen beneficios aparentemente grandes. En un comunicado de prensa, Eisai dice que Leqembi ralentiza la progresión de la demencia en un 27 por ciento. Eli Lilly dice que Kisunla ralentiza el declive hasta en un 35 por ciento.
Las matemáticas detrás de estas afirmaciones pueden volverse adormecedoras rápidamente, pero una analogía puede ayudar. Si se administraba un medicamento para perder peso a pacientes obesos y esos pacientes perdían dos libras en un año, mientras que los pacientes con un placebo perdían una libra, el fabricante del medicamento podría decir que los pacientes con el medicamento perdieron 100 por ciento más de peso que los que toman un placebo. Ese mismo tipo de matemáticas produce una diferencia del 27 por ciento entre los pacientes que tomaron Leqembi (en el ensayo único positivo) y los que tomaron un placebo, así como una diferencia del 35 por ciento en el ensayo Kisunla.
En el caso de Leqembi, dice Lon Schneider, profesor de psiquiatría, neurología y gerontología en la Universidad del Sur de California que consulta para fabricantes de medicamentos antiamiloides, el 27 por ciento es «un número sin sentido». Es un juego matemático que hace un mal uso de los datos».
Como nos dijo Jerome Hoffman, profesor emérito de UCLA y experto internacional en análisis de ensayos clínicos, «el veintisiete por ciento de casi nada sigue siendo casi nada».
Los fabricantes de medicamentos a veces también señalan los efectos de los medicamentos de manera temporal, diciendo que los medicamentos ralentizan el proceso de deterioro cognitivo por meses. Pero el Alzheimer es una enfermedad de progresión lenta. Y aunque esas pequeñas diferencias estadísticas podrían observarse durante un período de, digamos, seis meses, son diferencias que son demasiado pequeñas para ser percibidas por los pacientes y cuidadores. Sin embargo, los graves efectos secundarios son bastante discernibles.
Justo antes de que la FDA estuviera programada para considerar la aprobación de Leqembi, la Asociación de Alzheimer, la mayor organización sin fines de lucro dedicada a la enfermedad, tomó medidas.
La Asociación de Alzheimer presiona en nombre de sus miembros, apoya la investigación sobre el Alzheimer y proporciona servicios de educación y derivación a los pacientes de Alzheimer y a sus familias. El grupo ha promovido agresivamente los tres nuevos medicamentos.
En 2023, la organización sin fines de lucro recaudó 6,4 millones de dólares de treinta fabricantes de medicamentos, con donaciones de Eisai, Eli Lilly y Biogen que suman la mitad de esa cantidad. La asociación dice que las donaciones de la industria médica ascendieron a solo el 1,6 por ciento de sus ingresos anuales de 398 millones de dólares que figuran en su presupuesto de 2024. Sin embargo, la organización reconoció en un correo electrónico que aproximadamente el 30 por ciento de su presupuesto de 17,6 millones de dólares para conferencias y reuniones científicas provino de empresas de medicamentos y dispositivos médicos.
Cuando empezaron a aparecer los primeros resultados de Leqembi, la asociación reunió a un panel para reconsiderar el estándar aceptado para una diferencia significativa o “mínimamente clínicamente importante” en los resultados de la prueba CDR-SB. Después de revisar los primeros resultados del estudio, los panelistas concluyeron que, a la luz del beneficio “modesto” que produce el fármaco, “nuestras expectativas… pueden necesitar ser modificadas”.
Sugirieron que un cambio de tan solo 0,5 puntos en la prueba estándar, en lugar de un punto, podría considerarse una diferencia significativa. No se realizó ninguna investigación nueva para explicar la decisión del informe del panel, que se publicó justo antes de que la FDA tuviera previsto tomar su decisión final sobre Leqembi. En cambio, el nuevo estándar se basó en las impresiones de nueve médicos e investigadores, siete de los cuales tenían vínculos financieros con empresas que están desarrollando o comercializando fármacos antiamiloide.
La FDA le dijo a Lever que tuvo en cuenta la nueva definición de una diferencia clínicamente significativa al tomar su decisión. Aunque Leqembi ni siquiera superó el nuevo listón más bajo, la FDA aprobó el fármaco en julio de 2023.
“Atado al hospital”
La respuesta internacional a los nuevos fármacos contra el Alzheimer ha sido mixta. Los reguladores de Australia y la Agencia Europea de Medicamentos, la autoridad reguladora de la Unión Europea, se negaron en un principio a aprobar Leqembi. La Agencia Europea de Medicamentos dijo que el pequeño beneficio “no contrarresta el riesgo de eventos adversos graves”. Eisai apeló esa decisión y, en noviembre de 2024, obtuvo la aprobación para Leqembi, siempre que los médicos no lo receten a los pacientes de mayor riesgo. Kisunla, el fármaco más nuevo, todavía está bajo revisión en Europa.

Posteriormente, el Servicio Nacional de Salud del Reino Unido publicó su decisión de no pagar por Leqembi. Canadá todavía no ha tomado una decisión sobre el fármaco. China, Israel, los Emiratos Árabes Unidos, Corea del Sur y Japón han aprobado el fármaco.
Además de las preocupaciones por los efectos secundarios a veces fatales y los beneficios mínimos para los pacientes, los medicamentos son extremadamente caros. En abril, los Centros de Servicios de Medicare y Medicaid calcularon que Medicare gastaría 3.500 millones de dólares en Leqembi en 2025.
Todo esto plantea la pregunta de por qué se aprobaron los medicamentos en primer lugar.
Parte del aparente entusiasmo de la FDA por aprobar los nuevos medicamentos puede atribuirse al hecho de que el Alzheimer puede ser una enfermedad terrible, que afecta a cada vez más estadounidenses a medida que los baby boomers envejecen, y la agencia está bajo presión de todos los lados para abordarla.
La Asociación de Alzheimer y otros grupos de defensa de los pacientes se quejan rutinariamente de que la FDA está demorando el proceso, y presionan fuertemente a la agencia para que apruebe medicamentos cada vez más rápido, incluso aquellos que otros ven como problemáticos. Junto con las compañías farmacéuticas, muchos grupos de defensa han presionado al Congreso para que apruebe leyes como la Ley de Curas del Siglo XXI de 2016, que ha debilitado constantemente la autoridad de la FDA para exigir estándares científicos rigurosos antes de que se puedan aprobar medicamentos.
De 2019 a 2021, cuando Aduhelm estaba bajo revisión en la FDA, Biogen duplicó sus gastos de lobby de poco menos de 2 millones de dólares a más de 4 millones de dólares al año. Cuando Leqembi fue sometido a revisión en 2022, los gastos de lobby de Eisai aumentaron de 280.000 dólares en 2021 a más de 1,7 millones de dólares.
La industria farmacéutica ha contribuido a alimentar la percepción pública de la FDA como un impedimento en parte al gastar millones de dólares al año en grupos de defensa de los pacientes. Esos millones influyen en los mensajes que los grupos envían al Congreso y a la prensa.
Estas diversas fuerzas que actúan sobre la FDA no solo producen aprobaciones de medicamentos cuestionables, sino que también cierran otras vías de progreso. El afianzamiento de los medicamentos que destruyen las placas amiloides ha guiado las decisiones de financiación de las empresas farmacéuticas y los Institutos Nacionales de Salud, dejando otras posibles causas de la enfermedad de Alzheimer sin explorar adecuadamente. Además, el dinero que Medicare gastará en los nuevos medicamentos contra el Alzheimer no podrá destinarse a aliviar la carga de cuidar a los pacientes con Alzheimer.
“Los pacientes que toman estos medicamentos están atados al hospital”, dice Schrag, de la Universidad de Vanderbilt:
Además de las preocupaciones por los efectos secundarios a veces fatales y los beneficios mínimos para los pacientes, los medicamentos son extremadamente caros. En abril, los Centros de Servicios de Medicare y Medicaid calcularon que Medicare gastaría 3.500 millones de dólares en Leqembi en 2025.
La Asociación de Alzheimer y otros grupos de defensa de los pacientes se quejan rutinariamente de que la FDA está demorando el proceso, y presionan fuertemente a la agencia para que apruebe medicamentos cada vez más rápido, incluso aquellos que otros ven como problemáticos. Junto con las compañías farmacéuticas, muchos grupos de defensa han presionado al Congreso para que apruebe leyes como la Ley de Curas del Siglo XXI de 2016, que ha debilitado constantemente la autoridad de la FDA para exigir estándares científicos rigurosos antes de que se puedan aprobar medicamentos.
De 2019 a 2021, cuando Aduhelm estaba bajo revisión en la FDA, Biogen duplicó sus gastos de lobby de poco menos de 2 millones de dólares a más de 4 millones de dólares al año. Cuando Leqembi fue sometido a revisión en 2022, los gastos de lobby de Eisai aumentaron de 280.000 dólares en 2021 a más de 1,7 millones de dólares.
La industria farmacéutica ha contribuido a alimentar la percepción pública de la FDA como un impedimento en parte al gastar millones de dólares al año en grupos de defensa de los pacientes. Esos millones influyen en los mensajes que los grupos envían al Congreso y a la prensa.
Estas diversas fuerzas sobre la FDA no solo producen aprobaciones de medicamentos cuestionables, sino que también cierran otras vías de progreso. El afianzamiento de los medicamentos que destruyen las placas amiloides ha guiado las decisiones de financiación de las empresas farmacéuticas y los Institutos Nacionales de Salud, dejando otras posibles causas de la enfermedad de Alzheimer sin explorar adecuadamente. Además, el dinero que Medicare gastará en los nuevos medicamentos contra el Alzheimer no podrá destinarse a aliviar la carga de cuidar a los pacientes con Alzheimer.
“Los pacientes que toman estos medicamentos están atados al hospital”, dice Schrag, de la Universidad de Vanderbilt:
Tienen que someterse a pruebas exhaustivas, incluida una tomografía PET o una punción lumbar, para calificar para el tratamiento, luego venir físicamente a un centro de infusión cada dos o cuatro semanas para recibir el tratamiento y regresar varias veces en el primer año para las resonancias magnéticas. Si desarrollan efectos secundarios, que podrían ir desde dolores de cabeza hasta síntomas neurológicos incapacitantes, es posible que necesiten aún más pruebas.
Es en esta fase temprana del Alzheimer, comentario Schrag, cuando los médicos deberían alentar a los pacientes a abordar los elementos de su lista de deseos. «Diles: ‘Si quieres viajar o pasar tiempo con tus nietos, hazlo ahora'», . «Este es un momento en el que estás en tu mejor momento. Perderás la oportunidad de hacer otras cosas si corres de un lado a otro del hospital».
Hay mucho que todavía no sabemos sobre los nuevos medicamentos para el Alzheimer. Los estudios están en curso, y las evaluaciones tanto de los beneficios como de los daños pueden cambiar, para bien o para mal. Los expertos dicen que el acceso abierto a los conjuntos de datos del fabricante sería un desarrollo bienvenido, ya que permitiría a observadores independientes estudiar los efectos de los medicamentos más de cerca.
Pero con miles de millones de dólares en ingresos potenciales en juego, no es probable que los fabricantes de medicamentos publiquen sus datos o abandonen los productos o la cuestionable hipótesis del amiloide. Una empresa de análisis de negocios ya proyectado que las ventas globales de Leqembi y Kisunla totalizarán 5.500 millones de dólares en 2030.
Siete años después de eso, el informe final de Eli Lilly sobre la seguridad de Kisunla estará listo.
Este artículo es parte de una investigación sobre el proceso de aprobación de medicamentos de la Administración de Alimentos y Medicamentos y lo que significa para la seguridad y la salud pública. El proyecto cuenta con el apoyo de Lever y el McGraw Center for Business Journalism de la Escuela de Periodismo CUNY.